La masa molar de oxígeno. ¿Cuál es la masa molar de oxígeno?
Los átomos de elementos y compuestos de moléculas exhibir masa despreciable. Para el estudio de las relaciones cuantitativas específicas, a las reacciones químicas, utilizando varias cantidades físicas. Uno de ellos – la masa molar, que puede ser calculado para los átomos, iones y moléculas. Uno de los elementos más importantes de la Tierra – oxígeno, con su participación ocurren, muchas reacciones y procesos. Para llevar a cabo los cálculos de acuerdo con las fórmulas de los compuestos utilizados ecuaciones de reacción masa molar de oxígeno, que es numéricamente igual a su peso relativa de un átomo o molécula.
oxígeno
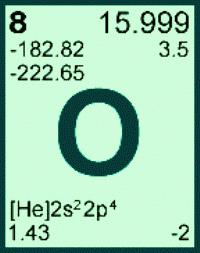
Información general sobre el oxígeno (elemento químico)
- Nombre en latín – oxygenium;
- símbolo químico – O;
- almacenado en la porción superior 16 del primer grupo (anteriormente – grupo VI A) de la tabla periódica;
- Se encuentra en el segundo período inmediatamente después de nitrógeno antes de flúor;
- Se refiere a un calcógeno familia;
- número de elemento en la tabla periódica y su carga de núcleos de los átomos – 8.
El oxígeno es uno de los componentes de la atmósfera durante un largo tiempo no pudo ser aislado en forma pura. Gas llamado el "dador de vida", "el elixir de la vida". Celebrar la apertura del oxígeno se divide entre los científicos conocidos en el mundo: K. Scheele, J. Priestley, Antoine Lavoisier .. El término "oxígeno" Lavoisier propuso, basado en el importante papel de la sustancia, sus átomos en la formación de óxidos y ácidos.

¿Cómo encontrar la masa molar de un elemento o sustancia?
Al realizar cálculos químicos necesario conocer la masa implicada en las reacciones de los átomos y las moléculas de las sustancias. Pero son demasiado pequeños, lo que complica el uso de tales unidades, como gramos y kilogramos. se encontró la solución: ofreció otros valores que facilitan los cálculos. Por ejemplo, en la química de los valores son de masa atómica y molecular relativa. La masa atómica relativa (Ar) como la cantidad física se ha introducido en la 1961 año. Su valor es igual a 1/12 de la masa de un átomo de carbono (el isótopo 12 C).
Para realizar cálculos utilizando fórmulas y ecuaciones con el uso de este y otros valores que recordar algunas reglas:
- átomo de masas en el sistema periódico contiene además de señal química. La masa molar tiene el mismo valor numérico, pero con las unidades de g / mol.
- Peso de un mol de la sustancia se determina a partir de la fórmula del compuesto son para los que la suma de la masa molar de todas las partículas en la molécula.
- Si la fórmula química es un índice que indica el número de unidades estructurales, es necesario multiplicar la masa molar de este coeficiente.
El peso atómico y molecular del oxígeno
La masa atómica se obtiene de oxígeno basado en el número y distribución de tres de sus isótopos naturales: Ar (G) = 15.999 (en un e m …). En los cálculos, este valor se redondea generalmente, se vuelve 16. Para cada elemento de su peso atómico – constante. A partir del peso conocido de átomos del elemento con número atómico 8 se pueden encontrar por la masa molar del elemento oxígeno. M (O) = 16. Otro cantidad física adimensional – el peso molecular de oxígeno – se refiere a una sustancia simple. Calcular la masa de la molécula de oxígeno, multiplicando el peso de un átomo en el coeficiente estequiométrico en la fórmula: Mr (O 2) = Ar (G). 2 = 16. 2 = 32. En la práctica, no hay necesidad de averiguar lo que la masa molar de oxígeno, debido a que su valor es numéricamente igual al peso de las moléculas de la sustancia, pero con la unidad de medida de g / mol. Para un compuesto particular es su peso molecular es constante, es ampliamente utilizada para calcular la cantidad y la masa de la sustancia.

cantidad de sustancia
En química, para la conveniencia de los cálculos, se utiliza una de las magnitudes físicas más importantes – la cantidad de sustancia. No se refiere al peso, y para el número de unidades estructurales. La unidad de medida de la cantidad de sustancia en la Internacional del sistema (SI) recibió 1 mol. Sabiendo que 1 mol incluye mismas partículas como están contenidos en 12 g de carbón isótopo 12 C se puede calcular el número de átomos, moléculas, iones, electrones contenidos en la porción de ensayo de cualquier sustancia. Otra constante fue el nombre del gran científico italiano Avogadro (denotado N A), Ella es el número de partículas estructurales que contiene una cantidad sustancia si – 1 mol. El valor numérico de la constante de Avogadro – 6,02. 23 de octubre de 1 / mol. Es el número de átomos (moléculas, iones) tiene una masa molar. Denominación de la cantidad física – unidad M – 1 g / mol, para la fórmula de cálculo – M = m / n (m – peso (g), n – cantidad de sustancia (mol)).
¿Qué es la masa molar de oxígeno
En la práctica, no hay necesidad de utilizar la fórmula M = m / n para calcular la masa molar de oxígeno. En la resolución de problemas es necesario para determinar la mayoría, lo que es la masa, o para encontrar una serie de sustancias. En el primer caso se utiliza para la fórmula de cálculo m = n. M, en el segundo – n = m / M. El valor numérico de la masa molar igual al átomo de elemento de masa, y para la sustancia – molécula. Por ejemplo, la masa de 16 g es 1 mol de elemento oxígeno. M (O 2) – la masa molar de la molécula de oxígeno, que es igual a 32 g / mol.
La masa molar de oxígeno equivalente
Llamado equivalente cantidad en peso igual de 1 mol de átomos monovalentes de cualquier elemento. En general, el peso equivalente se puede determinar dividiendo la masa molar de átomos del elemento químico en su valencia, que se encuentra por la fórmula del compuesto particular. En la mayoría de sus compuestos oxigenados como -elemento químico calcógeno es divalente. Masa molar del oxígeno se puede encontrar en la tabla periódica, su valor redondeado – 16. El peso equivalente de menos de 2 veces – 8 de química aplicables equivalentes de abogados, que establece que las sustancias se hacen reaccionar juntos en cantidades iguales a sus equivalentes. Cuando los cálculos que realizan pueden utilizar la masa molar equivalente de oxígeno para determinar el peso equivalente de la sustancia para la que se desconoce.

Oxígeno – uno de los elementos más importantes en la corteza terrestre, que representan el 46,6% de la masa. Una conexión simple con el mismo nombre – el segundo más común en la atmósfera de la tierra. El contenido de oxígeno molecular en el aire – 20,947% en volumen. Con la ayuda de átomos miembros y moléculas ocurrir muchas reacciones y procesos en la técnica, la industria, la naturaleza orgánica e inorgánica. Es importante tener en cuenta las relaciones cuantitativas en estos procesos, lo que facilita en gran medida el uso de cantidades físicas, incluyendo masa molar de oxígeno.


















