soluciones de electrolitos son líquidos especiales que son parcial o completamente en forma de partículas cargadas (iones). El mismo proceso de la división de las moléculas en el negativamente (aniones) y (cationes) partículas cargadas positivamente llamadas disociación electrolítica. La disociación en solución sólo es posible debido a la capacidad de los iones de interactuar con las moléculas del líquido polar que actúa como un disolvente.
¿Cuáles son los electrolitos
 Las soluciones de electrolitos se dividen en acuoso y no acuoso. Agua estudiado bastante bien y eran muy extendida. Están en casi todos los organismos vivos y participa activamente en muchos procesos biológicos importantes. electrolitos no acuosos se aplican para procesos electroquímicos y una variedad de reacciones químicas. Su uso ha llevado a la invención de nuevas fuentes de energía química. Juegan un papel importante en las células fotoelectroquímicas, síntesis orgánica, condensadores electrolíticos.
Las soluciones de electrolitos se dividen en acuoso y no acuoso. Agua estudiado bastante bien y eran muy extendida. Están en casi todos los organismos vivos y participa activamente en muchos procesos biológicos importantes. electrolitos no acuosos se aplican para procesos electroquímicos y una variedad de reacciones químicas. Su uso ha llevado a la invención de nuevas fuentes de energía química. Juegan un papel importante en las células fotoelectroquímicas, síntesis orgánica, condensadores electrolíticos.
Las soluciones de electrolitos, dependiendo del grado de disociación se pueden dividir en fuerte, media y débil. grado de disociación (α) – es la relación de las moléculas de trazos en las partículas cargadas con el número total de moléculas. En fuertes electrolitos valor alfa cercano a 1, en el α≈0,3 medio, y los débiles α <0,1.
Por lo general electrolitos fuertes incluyen sales, varios de ciertos ácidos – HCl, HBr, HI, HNO 3, H 2 SO 4, HClO 4, hidróxidos de bario, estroncio, calcio y metales alcalinos. Otros base y ácido – medio electrolítico o la fuerza débil.
soluciones de electrolitos Propiedades
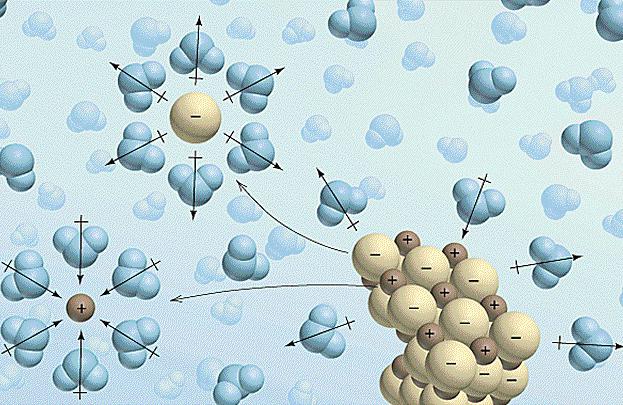 Las soluciones educativas a menudo están acompañados por efectos térmicos y los cambios en el volumen. El proceso de disolver el electrolito en el fluido tiene lugar en tres etapas:
Las soluciones educativas a menudo están acompañados por efectos térmicos y los cambios en el volumen. El proceso de disolver el electrolito en el fluido tiene lugar en tres etapas:
- La destrucción de los enlaces químicos y electrolito intermolecular disuelto requiere cuesta una cierta cantidad de energía y por lo tanto la absorción de calor se produce (bit? H> 0).
- En este paso, el disolvente comienza a interactuar con los iones de electrolitos, lo que resulta en la formación de solvatos (en solución acuosa – hidratos). Este proceso se conoce y es solvatación exotérmica, es decir, exotermia se produce (Δ H hidr <0).
- La última etapa – la difusión. Esta distribución uniforme de los hidratos (solvatos) en la solución a granel. Este proceso requiere el gasto de energía y por lo tanto la solución se enfría (diferencial? H> 0).
Por lo tanto, el efecto térmico total de la disolución de electrolito se puede escribir de la siguiente forma:
Sol? H =? H +? H descarga diferencial hidráulico? H +
A partir de ese, ¿cuáles serían los componentes de los efectos de la energía depende de la nota final del calor total de la disolución de los efectos de electrolitos. Por lo general, este proceso es endotérmico.
 Propiedades de la solución depende principalmente de la naturaleza de sus componentes constituyentes. Además, las propiedades de la composición de la solución de electrolito está influenciada, presión y temperatura.
Propiedades de la solución depende principalmente de la naturaleza de sus componentes constituyentes. Además, las propiedades de la composición de la solución de electrolito está influenciada, presión y temperatura.
Dependiendo del contenido de todas las soluciones de electrolitos soluto se puede dividir en muy diluido (en el que sólo contiene "trazas" de electrolitos), diluida (que contiene una pequeña cantidad de soluto) y se concentró (con un contenido significativo de electrolito).
Las reacciones químicas en soluciones de electrolitos, que son causadas por el paso de corriente eléctrica conduce al aislamiento de ciertos materiales para los electrodos. Este fenómeno se conoce como electrólisis y se utiliza a menudo en la industria moderna. En particular, debido a la electrólisis obtenido aluminio, hidrógeno, cloro, hidróxido de sodio, peróxido de hidrógeno, y muchas otras sustancias importantes.

















