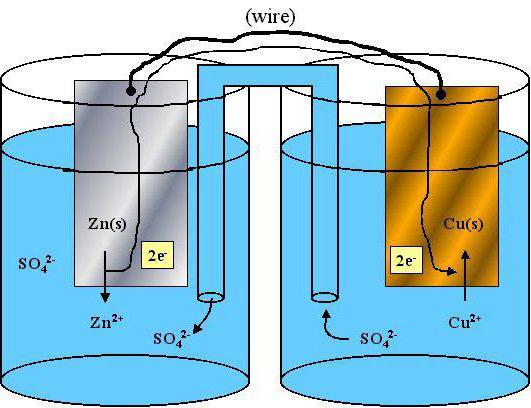
… propiedades reductoras tienen propiedades redox
propiedades redox de los átomos y iones individuales son un problema importante en la química moderna. Este material ayuda a explicar la actividad de los elementos y sustancias para llevar a cabo una comparación detallada de las propiedades químicas de los diferentes átomos.

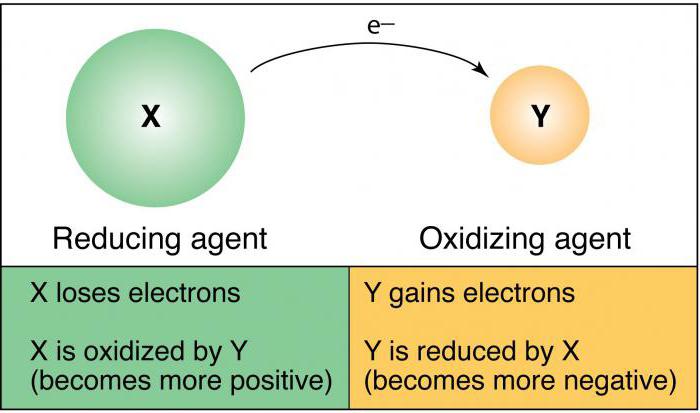
¿Cuál es el agente oxidante
Muchos problemas de química, incluyendo preguntas de la prueba del examen de estado unificado en el grado 11, y JEG en el noveno grado, asociados con este concepto. El oxidante se considera átomos o iones, que en el curso de la interacción química aceptar electrones de otro ión o átomo. Si analizamos las propiedades oxidantes de los átomos necesitan sistema periódico de Mendeleev. En el período, que se encuentran en la tabla de izquierda a derecha, la capacidad oxidante de los átomos aumenta, es decir, tienen unas similares propiedades no metálicas. El parámetro similares principales subgrupos disminuye hacia abajo. Entre los más poderosos de sustancias simples que tienen una capacidad oxidante, conducir fluoruro. Un término tal como "electronegatividad", es posible tomar un átomo en el caso de la interacción química de los electrones se puede considerar sinónimo con propiedades oxidativas. Entre sustancias complejas que constan de dos o más elementos químicos pueden ser considerados oxidantes brillantes: permanganato de potasio, clorato de potasio, el ozono.

¿Cuál es el agente reductor
La reducción de las propiedades típicas para los átomos de sustancias simples que presentan propiedades metálicas. En periodos de la tabla periódica en las propiedades metálicas, Izquierda debilitan, y en los subgrupos principales (vertical), que se amplifican. La esencia de la recuperación en el impacto de los electrones, que se encuentran en el nivel de energía exterior. Cuanto mayor sea el número de capas de electrones (niveles), la más fácil enviar durante la interacción química de los electrones "extra".
Excelentes propiedades reductoras tienen metales (alcalinas, alcalinotérreas) activos. Además, las sustancias que exhiben parámetros similares que distinguen el óxido de azufre (6), monóxido de carbono. Con el fin de obtener el máximo grado de oxidación, los compuestos tienen que mostrar la reducción de propiedades.
El proceso de oxidación
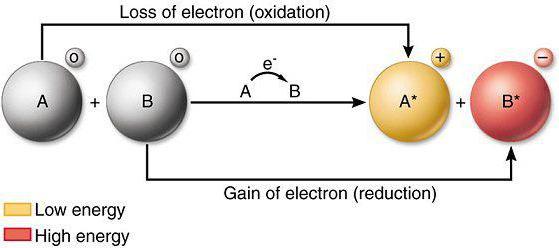
Si, durante la interacción química del átomo o ion pierde electrones a otro átomo (ion), se refiere al proceso de oxidación. Para un análisis de cómo los cambios que reducen las propiedades y la capacidad oxidativa, elementos de la tabla periódica, así como el conocimiento de las leyes actuales de la física requieren.

proceso de recuperación
procesos de reducción involucran la adopción de iones o electrones por átomos de otros átomos (iones) durante la interacción química directa. agentes reductores excelentes son nitritos, sulfitos de metales alcalinos. La reducción de las propiedades de elementos en el sistema de cambio de las propiedades del metal similares a sustancias simples.
Algoritmo de análisis OVR
Con el fin de reacción química lista del estudiante para organizar los coeficientes, debe utilizar un algoritmo especial. propiedades redox ayudar a resolver una variedad de tareas de diseño en la química analítica, orgánica, general. Solicitar ofrece ningún análisis de la reacción:
- En primer lugar, es importante definir cada elemento de estado de oxidación disponibles, usando las reglas.
- Siguiente definir esos átomos o iones, que han cambiado su estado de oxidación de participar en la reacción.
- Marcas "menos" y "más" indican el número de reparto adoptada durante la reacción química de los electrones libres.
- Además, entre el número de electrones se determina por el mínimo común múltiplo, es decir, un número entero que es divisible por electrones aceptados y se rindió.
- A continuación, se divide en electrones que participan en las reacciones químicas.
- A continuación, se determina exactamente el cual los iones o átomos tienen propiedades reductoras, así como determinar los oxidantes.
- En la etapa final de los coeficientes de posar en la ecuación.
Aplicando el método de la balanza electrónica, para colocar los coeficientes en un esquema de reacción dado:
NaMnO4 + ácido + sulfuro de hidrógeno sulfúrico = S + Mn SO 4 + … + …
Algoritmo para resolver este problema
Nos encontramos exactamente lo que debe ser formado después de la interacción de la materia. Puesto que la reacción ya está oxidante (que van de manganeso) y define agente reductor (que será azufre) sustancia formada que no está cambiando el grado de oxidación. Puesto que la reacción principal tiene lugar entre la sal y el ácido fuerte que contiene oxígeno, entonces uno de la sustancia final será agua, y la segunda – sal de sodio, más precisamente, sulfato de sodio.
Volvamos ahora esquema y la adopción del electrón:
– Mn 7 toma 5 e = Mn 2.
La segunda parte del esquema:
– S -2 = S 0 otdaet2e
Nos ponemos en las velocidades de reacción iniciales, sin olvidar resumir todos los átomos de azufre en los lados de la ecuación.
2NaMnO 4 + 5H 2 S + 3H 2 SO 4 = 5S + 2MnSO 4 + 8H 2 O + Na 2 SO 4.
Analizar OVR que implica peróxido de hidrógeno
La aplicación de la OVR análisis algoritmo puede equiparar la reacción química:
peróxido de hidrógeno + ácido sulfúrico + potasio permagnanat = Mn SO 4 + oxígeno + … + …
La oxidación de iones de oxígeno cambió (peróxido de hidrógeno) y catión de manganeso a permanganato de potasio. Es decir, un agente reductor y un agente oxidante, que están presentes.
Definir lo que es un material todavía puede suceder después de la interacción. Uno de ellos es el agua, que es obviamente representado por la reacción entre el ácido y la sal. Potasio no formar una nueva sustancia, el segundo producto sal de potasio, es decir, sulfato, como la reacción procedió con ácido sulfúrico.
conducción:
2O – 2 da electrones y transformado en O 2 0 5
Mn 7 5 recibe electrones y se convierte en un Mn 2 ion 2
Ponemos tasas.
5H 2 O 2 + 3H 2 SO 4 + 2KMnO = 5O 2 4 + 2Mn SO 4 + 8H 2 O + K 2 SO 4
Ejemplo OVR análisis sintáctico con cromato de potasio
Utilizando el método de balanza electrónica, establecer una ecuación con coeficientes:
FeCl 2 + Ácido clorhídrico + potasio cromato = FeCl 3 + CrCl 3 + … + …
hierro Changed estado de oxidación (cloruro de hierro en II) y de iones de cromo en bicromato de potasio.
Ahora tratamos de averiguar lo que se forman otras sustancias. Uno puede ser una sal. Como potasio no se forma ningún compuesto de este modo el segundo producto es una sal de potasio, más precisamente, cloruro, porque la reacción se llevó a cabo con ácido clorhídrico.
Al gráfico:
Fe 2 envía e = Fe 3 6 reductor
2Cr 6 6 recibe e = 2Cr 3 1 oxidante.
Nos planteamos los coeficientes de la reacción inicial:
6K 2 Cr 2 O 7 + FeCl 2 + 14HCl = 7H 2 O + 6FeCl 3 + 2CrCl 3 + 2KCl
Ejemplo OVR análisis con yoduro de potasio
Armado con las normas, establecer una ecuación:
permanganato de potasio + ácido + yoduro de potasio sulfúrico, sulfato de manganeso + … yodo + … + …
estado de oxidación cambió manganeso y yodo. Ese es el reductor y el oxidante están presentes.
Ahora nos damos cuenta que al final hemos formado. El compuesto tendrá potasio, es decir, obtener sulfato de potasio.
procesos de reducción se producen en los iones de yodo.
Formar el esquema de transferencia de electrones:
– Mn 7 5 recibe e = Mn 2 2 es un agente oxidante,
– 2I – da E = I 2 2 0 5 es un agente reductor.
Organizamos los coeficientes de la reacción inicial, mientras que no se olvide de resumir todos los átomos de azufre en la ecuación.
210KI + KMnO 4 + 8H 2 SO 4 = 2MnSO 4 + 5I 2 + 6K 2 SO 4 + 8H 2 O
Ejemplo OVR análisis sintáctico con sulfito de sodio
Utilizando el método clásico, elaboramos los planes para la ecuación:
– Ácido sulfúrico + KMnO 4 + … sulfito de sodio, sulfato de sodio, sulfato de manganeso + … + … +
Después de reaccionar obtener agua sal de sodio.
Al gráfico:
– Mn 7 5 recibe e = Mn 2 2
– S 4 2 envía e = S +6 5.
Organizamos los coeficientes en esta reacción no se olvide de poner los átomos de azufre en el establecimiento de coeficientes.
3H 2 SO 4 + 2KMnO 4 + 5Na 2 SO 3 = K 2 SO 4 + 2MnSO 4 + 5Na 2 SO 4 + 3H 2 O.
Ejemplo de análisis OVR con nitrógeno
Completar las siguientes tareas. Usando el algoritmo, que forman una ecuación de reacción completa:
– nitrato de manganeso + ácido nítrico + PbO 2 = HMnO 4 + Pb (NO 3) 2 +
Analicemos qué sustancia incluso formas. Puesto que la reacción se llevó a cabo entre un agente oxidante fuerte y sal, entonces la sustancia es agua.
Vamos a mostrar el cambio en el número de electrones:
– Mn 2 5 envía e = Mn 7 2 presenta las propiedades de un agente reductor,
– Pb 4 2 recibe e = Pb 2 5 oxidante.
3. Organizamos los coeficientes de la reacción inicial, cuidadosamente sumar todo el nitrógeno presente en el lado izquierdo de la ecuación inicial:
– 2Mn (NO 3) 2 + 6HNO 3 + 5PbO 2 = 2HMnO 4 + 5PB (NO 3) 2 + 2H 2 O.
En esta reacción, propiedades reductoras no se manifiestan de nitrógeno.
Una segunda muestra de la reacción redox con nitrógeno:
Zn + ácido sulfúrico + HNO 3 = ZnSO 4 + NO + …
– Zn 0 2 envía e = Zn 2 3 ser agente reductor,
N 5 3 recibe e = N 2 2 es el oxidante.
Ponemos los coeficientes en una reacción predeterminada:
3Zn + 3H 2 SO 4 + 2HNO 3 = 3ZnSO 4 + 2NO + 4H 2 O.
La importancia de las reacciones redox
La reacción más conocido de reducción – fotosíntesis, una planta típica. Cómo cambiar las propiedades de recuperación? El proceso ocurre en la biosfera, que conduce a un aumento de energía con una fuente externa. Es esta energía y utiliza para sus necesidades de la humanidad. Ejemplos de oxidantes y reductores reacciones asociadas con elementos químicos, son de particular importancia la conversión de compuestos de nitrógeno, carbono, oxígeno. A través de la fotosíntesis atmósfera de la Tierra tiene una composición tal que se requiere para el desarrollo de los organismos vivos. A través de la fotosíntesis no aumenta el dióxido de carbono en la carcasa de aire, la superficie de la Tierra no se sobrecalienta. La planta se desarrolla no sólo a través de reacción redox, pero las formas tales sustancias a seres humanos, tales como el oxígeno, la glucosa se desea. Sin esta reacción química no puede ser un ciclo completo de la materia en la naturaleza, así como la existencia de la vida orgánica.
Aplicación práctica OVR
A fin de mantener la superficie del metal, es necesario saber que han propiedades reductoras metales activos, por lo tanto, es posible cubrir la capa de superficie sobre el elemento activo, ralentizando así el proceso de corrosión química. Debido a las propiedades redox de limpieza y desinfección de agua potable. Ninguno de los dos problema no puede resolverse sin haber colocado correctamente en los coeficientes de la ecuación. Con el fin de evitar errores, es importante tener una idea acerca de todos los parámetros redox.
Protección contra la corrosión química
En particular reto para la vida y la actividad humana es la corrosión. Como resultado de la conversión química de la insuficiencia de metal, perdiendo sus piezas de automóviles de rendimiento, máquinas herramientas. Con el fin de corregir un problema tal, el uso de la protección sacrificial, una capa de revestimiento de metal de barniz o pintura aplicando aleaciones anticorrosivas. Por ejemplo, la superficie de acero está cubierta con una capa de metal activo – aluminio.
conclusión
Una variedad de reacciones de reducción se producen en el cuerpo, garantizar el funcionamiento normal del sistema digestivo. Tales procesos básicos de la vida como la fermentación, putrefacción, la respiración, también se asocia con la reducción de propiedades. Tienen características similares, todos los seres vivos de nuestro planeta. Sin reacción con dedicación y la aceptación de los electrones no pueden ser minería, la producción industrial de amoníaco, álcalis, ácidos. En todas las técnicas de química analítica análisis volumétrico se basa en los procesos redox. Lucha con tal fenómeno desagradable de la corrosión química, sino que también se basa en el conocimiento de estos procesos.