Acid: mesa de ejemplos. propiedades de los ácidos
Acids – estos son compuestos químicos que son capaces de dar un ión cargado eléctricamente (catión) hidrógeno, y aceptan electrones dos vzaimodeystvuschih, formando de este modo un enlace covalente.
En este artículo se considera el ácido básico, que se enseña en las clases de secundaria de las escuelas secundarias, así como aprender muchos datos interesantes sobre diversos ácidos. Proceder.

Ácidos: Tipos
En química hay una gran cantidad de diversidad de ácidos, que tienen propiedades muy diferentes. Los químicos distinguen contenido de ácido que consiste en oxígeno, en la volatilidad, solubilidad en agua, la fuerza, la estabilidad, que pertenece a la clase de compuestos químicos orgánicos o inorgánicos. En este artículo vamos a ver una tabla que presenta el ácido más famoso. Tabla puede ayudarle a recordar el nombre del ácido y su fórmula química.
| fórmula química | Nombre del ácido |
| H 2 S | sulfuro de hidrógeno |
| H 2 SO 4 | sulfúrico |
| HNO 3 | nítrico |
| HNO 2 | nitroso |
| HF | fluorhídrico |
| HCl | sal |
| H 3 PO 4 | fosforoso |
| H 2 CO 3 | carbón |
Por lo tanto, todo claramente visible. Esta tabla muestra la más conocida en el ácido industria química. La tabla siguiente le ayudará mucho más rápido para recordar nombres y fórmulas.

ácido sulfhídrico
H 2 S – sulfuro de hidrógeno es el ácido. Su peculiaridad radica en el hecho de que también es un gas. El sulfuro de hidrógeno es muy mala rastovoryaetsya en agua, así como interactuar con tantos metales. ácido sulfuro de hidrógeno pertenece al grupo de "ácido débil", ejemplos de los cuales vamos a discutir en este artículo.
H 2 S tiene un sabor ligeramente dulce y olor muy penetrante a huevos podridos. En la naturaleza, que se puede encontrar en el gas natural o volcánica, y se libera cuando la putrefacción de proteínas.
Propiedades ácidos son muy diversas, incluso si el ácido es indispensable en la industria, puede ser muy poco rentable para la salud humana. Este ácido es muy tóxico para el hombre. Por inhalación de una pequeña cantidad de sulfuro de hidrógeno en el hombre despierta dolor de cabeza comienza náuseas y mareos grave. Si una persona inhala grandes cantidades de H 2 S, que puede conducir a convulsiones, coma o incluso la muerte súbita.
ácido sulfúrico
H 2 SO 4 – es un ácido sulfúrico fuerte, a la que se introducen los niños en clases de química incluso en la clase octava. ácidos químicos tales como ácido sulfúrico, son oxidantes muy fuertes. H 2 SO 4 actúa como un oxidante para muchos metales, y óxidos básicos.
H 2 SO 4 en contacto con la piel o la ropa provoca quemaduras químicas, pero no es tan tóxico como sulfuro de hidrógeno.
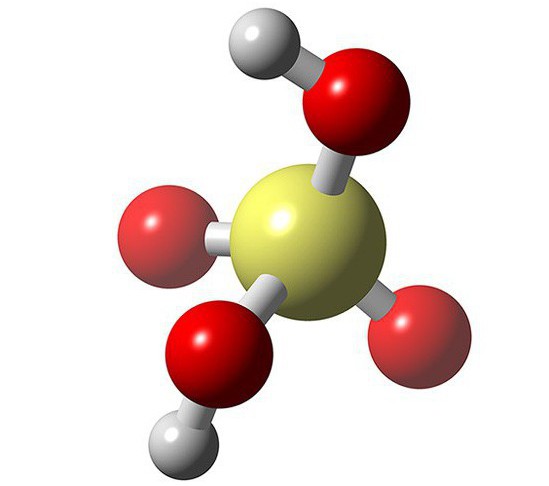
ácido nítrico
En nuestro mundo, es importante el ácido fuerte. Ejemplos de tales ácidos: HCl, H 2 SO 4, HBr, HNO 3. HNO 3 – es conocido por todos ácido nítrico. Ha sido ampliamente utilizado en la industria y en la agricultura. Se utiliza para la fabricación de diversos fertilizantes, joyas, impresión de fotografías, en la fabricación de medicamentos y colorantes, así como en la industria de defensa.
Tal ácido químico tal como ácido nítrico, son muy perjudiciales para el organismo. HNO3 pares úlceras izquierda, causan inflamación aguda y la irritación de las vías respiratorias.
ácido nitroso
El ácido nitroso es muy a menudo confundido con nitrógeno, pero la diferencia entre ellos es. El hecho de que el ácido nitroso es mucho menos nitrógeno, completamente diferentes propiedades y efectos en el cuerpo humano.
HNO 2 ha sido ampliamente utilizado en la industria química.
ácido fluorhídrico
El ácido fluorhídrico (o fluoruro de hidrógeno) – una solución de H 2 O c HF. ácido amida – HF. El ácido fluorhídrico es muy ampliamente utilizado en la industria del aluminio. Se silicatos disueltos, silicio grabado al ácido, vidrio de silicato.
El fluoruro de hidrógeno es muy perjudicial para el cuerpo humano, dependiendo de la concentración del fármaco puede ser fácil. En caso de contacto con la piel, en primer lugar ningún cambio, pero después de unos minutos, puede recibir un fuerte dolor y quemaduras químicas. El ácido fluorhídrico es muy perjudicial para el medio ambiente.
ácido clorhídrico
HCl – es cloruro de hidrógeno, es un ácido fuerte. ácido cloruro de hidrógeno conserva las propiedades que pertenecen al grupo más fuerte. En la forma de ácido es transparente e incoloro, y al vapor en el aire. El cloruro de hidrógeno se utiliza ampliamente en las industrias del acero y de los alimentos.
Este ácido causa quemaduras, pero especialmente peligroso su contacto con los ojos.
ácido fosfórico
El ácido fosfórico (H 3 PO 4) – se encuentra en sus propiedades ácidas débiles. Pero incluso los ácidos débiles pueden tener propiedades fuertes. Por ejemplo, H 3 PO 4 se utilizan en la industria para la reducción de óxido de hierro. Además, forsfornaya (o fosfórico) ácido es ampliamente utilizado en la agricultura – que está hecho de una amplia variedad de fertilizantes.
Propiedades ácidos son muy similares – sustancialmente cada uno de ellos es muy perjudicial para el cuerpo humano, H 3 PO 4 no es una excepción. Por ejemplo, este ácido también causa quemaduras graves, hemorragia de la nariz, y también los dientes se desmoronan.
ácido carbónico
H 2 CO 3 – ácido débil. Se obtiene por disolución de CO 2 (dióxido de carbono) en H 2 O (agua). El ácido carbónico se usa en la biología y la bioquímica.
Densidad de diferentes ácidos
densidad del ácido juega un papel importante en las partes teóricas y prácticas de la química. Gracias al conocimiento de la densidad puede determinar la concentración de un ácido en particular, calculado para resolver problemas químicos y añadir la cantidad correcta de ácido para llevar a cabo la reacción. Densidad cualquier ácido varía dependiendo de la concentración. Por ejemplo, cuanto mayor es la concentración del porcentaje, mayor es la densidad.

Las propiedades generales de ácidos
Absolutamente todas las sustancias de ácido son complejos (es decir, consistir en varios elementos de la tabla periódica), por lo que necesariamente incluir en su composición H (hidrógeno). A continuación, tenemos en cuenta las propiedades químicas de los ácidos, que son comunes:
- Todos ácido oxigenado (que está presente en la fórmula O) formado durante la descomposición del agua, y un óxido ácido. Así, un anóxica descomponerse en sustancias más simples (por ejemplo, 2HF se descompone en F 2 y H 2).
- Acid-oxidantes reaccionan con todos los metales entre actividad metales (solamente los situados a la izquierda del H).
- Interactúa con diversas sales, pero los que se forma el ácido más débil.
Las propiedades físicas de los ácidos difieren mucho uno de otro. Después de todo, pueden tener un olor, y no tenerlo, pero también estar en diversos estados de agregación: líquido, gaseoso o incluso sólidos. Es muy interesante estudiar el ácido sólido. Ejemplos de tales ácidos: C 2 H 2 0 4 y H 3 BO 3.

concentración
La concentración es la cantidad que determina la composición cuantitativa de cualquier solución. Por ejemplo, los químicos a menudo necesario para determinar la cantidad de ácido en diluida de H 2 SO 4 es el ácido sulfúrico puro. Para este propósito se vierta una pequeña cantidad de ácido diluido en un vaso de precipitados, se pesaron y densidad determinada tabla de concentraciones. concentración de ácido interconectado estrechamente con determinación de la densidad kontsetratsii encuentra a menudo tareas de cálculo donde es necesario para determinar el porcentaje de ácido puro en la solución.
Clasificación por el número de átomos de H ácidos en su fórmula química
Una de las clasificaciones más populares es la separación de ácidos, monobásico, dibásico y, en consecuencia, ácidos tribásicos. Ejemplos de ácidos monobásicos: HNO 3 (ácido nítrico), HCl (clorhídrico), HF (ácido fluorhídrico) y otros. Estos ácidos se llaman monobásico, ya que su composición sólo hay un átomo de H. Hay muchos ácidos, absolutamente imposible recordar cada uno. Basta recordar que el ácido es clasificada y el número de átomos de H en su estructura. Se definen de manera similar y diácidos. Ejemplos: H 2 SO 4 (ácido sulfúrico), H 2 S (sulfuro de hidrógeno), H 2 CO 3 (carbón) y otros. Tribásico: H 3 PO 4 (ácido fosfórico).

Los principales ácidos de clasificación
Una de las clasificaciones más populares de ácidos es dividirlos en oxigenada y libre de oxígeno. ¿Cómo recordar, sin saber la fórmula química de la sustancia que es el ácido que contiene oxígeno?
Nos todos los ácidos de hidrógeno en la composición no es un elemento importante de O – oxígeno, pero hay una parte de H. Por lo tanto, su nombre siempre se atribuye a la palabra "hidrógeno". HCl – es ácido clorhídrico, un H 2 S – sulfuro de hidrógeno.
Sino también por los nombres kislosoderzhaschih ácidos pueden escribir la fórmula. Por ejemplo, si el número de átomos de O en el material – 4 o 3 a continuación, siempre añadido a la -n- sufijo de nombre y terminando -aya-:
- H 2 SO 4 – ácido sulfúrico (número de átomos – 4);
- H 2 SiO 3 – silicio (número de átomos – 3).
Si un material es menos de tres átomos de oxígeno, o tres, se utiliza el título -ist- sufijo:
- HNO 2 – nitroso;
- H 2 SO 3 – sulfuroso.

Las propiedades comunes
Todos los ácidos tienen un sabor agrio, ya menudo un poco metálico. Pero hay otras propiedades similares, que ahora consideramos.
Hay sustancias llamadas indicadores. Los indicadores cambian de color, o se mantiene el color, sino que cambia su tonalidad. Esto se produce en un momento en los LEDs están en otras sustancias tales como el ácido.
Un ejemplo de un cambio de color puede servir como tal familiar para muchos productos tales como té, y ácido cítrico. Al lanzar el té té de limón y luego poco a poco se comenzó a aligerar considerablemente. Esto es debido al hecho de que el limón contiene ácido cítrico.

Hay otros ejemplos. Litmus, que se vuelve rojo en medio neutro tiene un color púrpura, la adición de ácido clorhídrico.
En la reacción de los ácidos con los metales en la serie electromotriz de burbujas de gas de hidrógeno se asignan – H. Sin embargo, si el tubo se colocó con un metal ácido que está en tensión después de la fila H, entonces no se producirá ninguna reacción, desprendimiento de gas será. Por ejemplo, cobre, plata, mercurio, platino y oro para reaccionar con ácidos no lo son.
En este artículo, nos fijamos en los ácidos químicos más famosos, así como sus principales características y diferencias.