La célula de cada organismo vivo, millones de reacciones químicas tienen lugar. Cada uno de ellos es importante, por lo que es importante mantener la velocidad de los procesos biológicos en un nivel alto. Casi cada reacción es catalizada por su enzima. ¿Cuáles son las enzimas? ¿Cuál es su papel en una jaula?
Las enzimas. definición
El término "enzima" se deriva del latín fermentum – levadura. Ellos también pueden ser llamados enzimas del griego en zima – "a pasos agigantados".
Enzimas – sustancias biológicamente activas, por lo que cualquier reacción que se produce en la célula, no pueden prescindir de ellos. Estos compuestos actúan como catalizadores. En consecuencia, cualquier enzima tiene dos propiedades principales:
1) Enzyme acelera la reacción bioquímica, pero no se consume.
2) El valor de la constante de equilibrio no cambia, pero sólo acelera el logro de este valor.
Las enzimas aceleran las reacciones bioquímicas en los miles, y en algunos casos, un millón de veces. Esto significa que, en ausencia del sistema enzimático todos los procesos intracelulares se ha detenido virtualmente, y la propia célula muere. Por lo tanto, el papel de las enzimas como ingredientes activos es alta.
Una variedad de enzimas hace posible diversificar regular el metabolismo celular. En cualquier cascada de reacciones que participen a muchas clases diferentes de enzimas. catalizadores biológicos tienen una alta selectividad a través de una conformación específica de la molécula. T. Para. En la mayoría de los casos las enzimas son proteínas en la naturaleza, que son en la estructura terciaria o cuaternaria. La razón es otra vez la especificidad de la molécula. 
La función de las enzimas en la célula
La tarea principal de la enzima – aceleración de reacción correspondientes. Cualquier proceso en cascada, ya que la descomposición del peróxido de hidrógeno y la glucólisis que termina, requiere la presencia de un catalizador biológico.
El funcionamiento apropiado de enzimas logra una alta especificidad para un sustrato específico. Esto significa que el catalizador sólo puede acelerar cierta reacción y no más, incluso muy similares. Por el grado de especificidad de la enzima, los siguientes grupos:
1) enzimas con especificidad absoluta cuando catalizada por una sola reacción individual. Por ejemplo, colagenasa digiere el colágeno, y se unirá maltasa maltosa.
2) enzimas con especificidad relativa. Esto incluye sustancias que pueden catalizar una cierta clase de reacciones, por ejemplo, escisión hidrolítica.
trabajo biocatalizador comienza con la conexión de su sitio activo al sustrato. Al mismo tiempo hablar de la interacción complementaria similar a una llave. Esto se refiere a un partido lleno con el sustrato forma el centro activo, que hace posible acelerar la reacción.
El siguiente paso consiste en el curso de la reacción. Su velocidad aumenta por la acción del complejo enzimático. Al final, se obtiene la enzima, que está asociada con los productos de reacción.
etapa final – para eliminar los productos de reacción de la enzima, después de lo cual el sitio activo vuelve a ser libre para otra operación.
Esquemáticamente, el trabajo de la enzima en cada etapa se puede escribir como:
1) S + E -> SE
2) SE -> SP
3) SP -> S + P, en donde S – es el sustrato, E – la enzima, y P – producto. 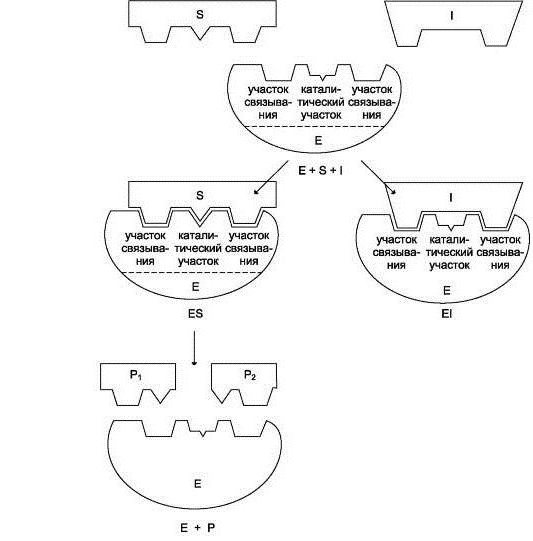
clasificación de enzimas
En el cuerpo humano, se puede encontrar una gran cantidad de enzimas. Todo el conocimiento acerca de sus funciones y el trabajo se sistematizó, y como resultado hubo una nomenclatura común, a través del cual se puede determinar fácilmente qué es un catalizador particular. Aquí hay seis clases básicas de enzimas, así como algunos ejemplos de los subgrupos.
- Oxidorreductasa.
Las enzimas de esta clase catalizan reacciones redox. Total se recuperó 17 subgrupos. Las oxidorreductasas son por lo general no proteico porción proporcionado vitamina o hemo.
Entre las oxidorreductasas menudo se encuentran los siguientes subgrupos:
a) deshidrogenasa. enzima Bioquímica-deshidrogenasa se surcaba átomos de hidrógeno y su transferencia a otro sustrato. Este subgrupo es más común en las reacciones de la respiración, la fotosíntesis. Como parte de la deshidrogenasa es necesariamente presente en la forma de la coenzima NAD / NADH o flavoproteínas FAD / FMN. A menudo hay iones metálicos. Los ejemplos incluyen enzimas tales como tsitohromreduktazy, piruvato deshidrogenasa, isocitrato deshidrogenasa, y también muchas enzimas hepáticas (lactato deshidrogenasa, glutamato deshidrogenasa, y así sucesivamente. D.).
b) oxidasas. Un número de enzimas catalizan la adición de oxígeno a hidrógeno, con lo que los productos de reacción pueden ser agua o peróxido de hidrógeno (H 2 0, H 2 0 2). Los ejemplos de las enzimas citocromo oxidasa, tirosinasa.
c) peroxidasa y catalasa – enzimas que catalizan la descomposición H 2 O 2 en agua y oxígeno.
g) oxigenasa. Estos biocatalizadores aceleran unión de oxígeno al sustrato. Dofamingidroksilaza – uno de los ejemplos de tales enzimas.
2. Las transferasas.
enzimas objetivo de este grupo es la transferencia de los radicales de la sustancia de la sustancia donante al receptor.
a) metiltransferasa. ADN metiltransferasa – enzimas clave que controlan el proceso de replicación del ADN. nucleótidos de metilación juega un papel importante en la regulación del trabajo de ácido nucleico.
b) aciltransferasa. Las enzimas de este subgrupo son transportados de una molécula a otro grupo acilo. Ejemplos aciltransferasas: lecitina colesterol aciltransferasa (lleva grupo funcional con un ácido graso en colesterol), lizofosfatidilholinatsiltransferaza (grupo acilo se transfiere a lisofosfatidilcolina).
c) aminotransferasas – enzimas que están implicadas en la conversión de los aminoácidos. Ejemplos de las enzimas alanina aminotransferasa que cataliza la síntesis de alanina a partir de piruvato y glutamato mediante la transferencia de un grupo amino.
g) fosfotransferasa. Las enzimas catalizan la adición de este subgrupo del grupo fosfato. Otro nombre fosfotransferasa quinasa, es más común. Los ejemplos incluyen enzimas tales como la hexoquinasa y el aspartato, que están unidos a los residuos de fosfato de hexosa (principalmente glucosa) y ácido aspártico , respectivamente.
3. Hidrolasas – una clase de enzimas que catalizan la escisión de enlaces en la molécula, seguido por adición de agua. Sustancias que pertenecen a este grupo – la principal enzima digestiva.
a) esterasas – romper los enlaces éster. Ejemplo – lipasas que descomponen las grasas.
b) glicosidasas. enzimas Bioquímica de esta serie se encuentra en la destrucción de los enlaces glicósido de polímeros (oligosacáridos y polisacáridos). Ejemplos: amilasa, sacarasa, maltasa.
c) peptidasa – enzimas que catalizan la descomposición de las proteínas a los aminoácidos. enzimas relacionadas peptidasa como la pepsina, tripsina, quimotripsina, karboiksipeptidaza.
g) amidasas – bonos cleave amida. Ejemplos: .. arginasa, ureasa, glutaminasa etc. Muchos amidasa enzimas se encuentran en el ciclo de la ornitina.
4. liasas – enzimas para funciones similares a hidrolasas, sin embargo, en la escisión de enlaces en las moléculas que no se consumen agua. Las enzimas de esta clase siempre tienen una parte de la porción no proteico, por ejemplo, en forma de vitaminas B1 y B6.
a) descarboxilasa. Estas enzimas actúan sobre el enlace C-C. Ejemplos de ello son la decarboxilasa del ácido glutámico o piruvato descarboxilasa.
b) hidratasa y deshidratasa – enzimas que catalizan la escisión de enlaces C-O.
c) la amidina-liasas – destruir enlace C-N. Ejemplo: argininsuktsinatliaza.
g) R-O liasa. Tales enzimas son por lo general escinden un grupo fosfato a partir de un material de sustrato. Ejemplo: la adenilil ciclasa. 
La bioquímica de las enzimas en función de su estructura
La capacidad de cada enzima se determinó por el individuo, sólo su estructura inherente. Cualquier enzima – es principalmente proteína, y su estructura y el grado de plegamiento juegan un papel crucial en la determinación de su función.
Cada biocatalizador se caracteriza por la presencia del centro activo, que, a su vez, se divide en varias áreas funcionales distintas:
1) Catalytic Center – una región especial de la proteína, en el que la adherencia de la enzima al sustrato. Dependiendo de la conformación de la proteína centro catalítico molécula puede tomar una variedad de formas, que debe corresponder al sustrato, así como una cerradura y llave. Tal estructura compleja explica por qué la proteína enzimática está en el estado terciario o cuaternario.
2) La adsorción Centro – sirve como un "titular". Aquí, en primer lugar se realiza la comunicación entre la molécula de la enzima y la molécula de sustrato. Sin embargo, la conexión que forma el centro de adsorción, muy débil, y por lo tanto la reacción catalítica es reversible en esta etapa.
3) centros alostéricos pueden estar situados en el centro activo, ya través de toda la superficie de la enzima. Su función – la regulación de la enzima. Reglamento tiene lugar a través de inhibidores de moléculas y moléculas de activadores.
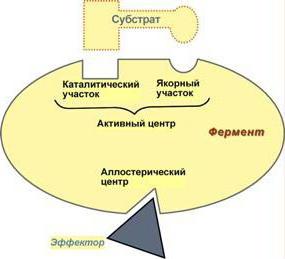
Las proteínas activadoras de unión a la molécula de enzima, aceleran su funcionamiento. Inhibidores, por el contrario, inhiben la actividad catalítica, y esto puede ocurrir de dos maneras: o bien la molécula se une a la región centro alostérico del centro activo de la enzima (inhibición competitiva) o está unido a otra región de la proteína (inhibición no competitiva). La inhibición competitiva se considera más eficaz. Después de espacio así cerrado para la unión del sustrato a la enzima, y este proceso sólo es posible en el caso de coincidencia prácticamente completa de la molécula de inhibidor y formar un centro activo.
Enzyme menudo no consiste de aminoácidos, pero también de otras sustancias orgánicas e inorgánicas. De acuerdo con ello, aislado apoenzima – porción proteínica coenzima – resto orgánico y cofactor – parte inorgánica. La coenzima se puede representar ulgevodami, grasas, ácidos nucleicos, vitaminas. A su vez, el co-factor – es a menudo una iones metálicos de soporte. La actividad enzimática se determina por su estructura: sustancias adicionales incluidos en la composición, alterar las propiedades catalíticas. Varios tipos de enzimas – es el resultado de una combinación de todos estos factores forman un complejo. 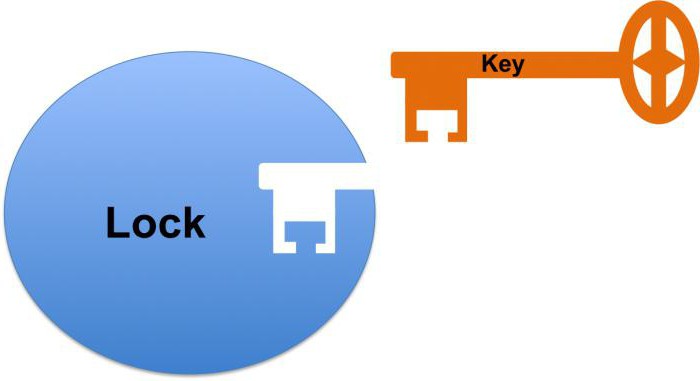
Reglamento de la obra de enzimas
Enzimas como la sustancia biológicamente activa no siempre es necesario para el cuerpo. La bioquímica de las enzimas es que se puede, en el caso de las células vivas excesivo daño catálisis. Para evitar efectos perjudiciales sobre las enzimas necesarias para regular el cuerpo de alguna manera su trabajo.
T. Para. Las enzimas son de naturaleza proteica, que se destruyen fácilmente a altas temperaturas. proceso de desnaturalización es reversible, pero puede afectar significativamente la sustancia.
pH también juega un papel importante en la regulación. La actividad máxima de la enzima se observa generalmente a pH neutro (7,0-7,2). También tiene enzimas que trabajan sólo bajo condiciones ácidas o sólo en alcalina. Así, en los lisosomas celulares mantenido pH bajo, en la que la actividad máxima de enzimas hidrolíticas. En el caso de contacto accidental con el citoplasma, donde el ambiente es más cercano a la posición neutra, su actividad disminuirá. Dicha protección de "samopoedaniya" se basa en las características de la hidrolasa.
Vale la pena mencionar acerca de la importancia de la coenzima y cofactor en la composición de las enzimas. La presencia de vitaminas o iones metálicos afectan significativamente el funcionamiento de algunas enzimas específicas. 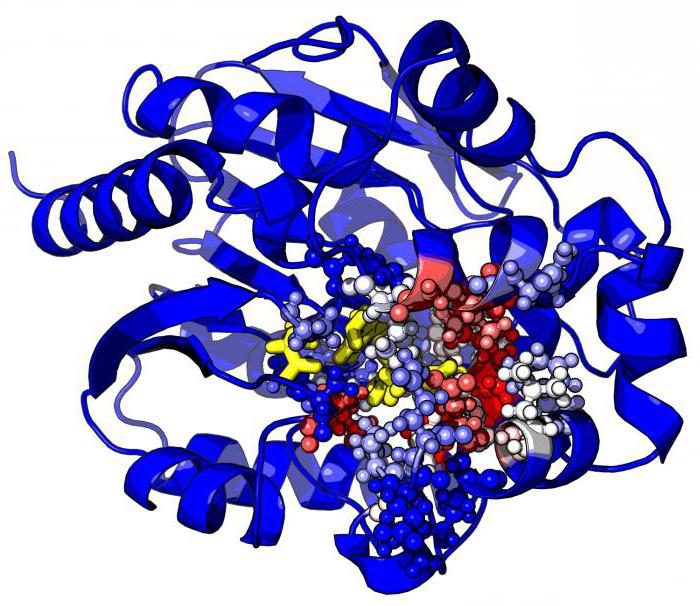
Nomenclatura de las enzimas
Todas las enzimas del cuerpo se denominan de acuerdo con su pertenencia a cualquiera de las clases, así como el sustrato con el cual reaccionan. A veces la nomenclatura sistemática utilizada no uno, sino dos de sustrato en el título.
Ejemplos de nombres de algunas enzimas:
- Las enzimas hepáticas: lactato degidrogen aza-glutamato-aza-degidrogen.
- Nombre completo sistemática de la enzima: lactato + NAD-aza -oksidoredukt.
Conservados y triviales nombres, que no se adhieren a las reglas de nomenclatura. Algunos ejemplos son: las enzimas digestivas tripsina, quimotripsina, pepsina.
El proceso de la síntesis de enzimas
Las funciones de las enzimas se determinan incluso a nivel genético. Ya que la molécula es por lo general -. La proteína, y su síntesis es exactamente el mismo que los procesos de transcripción y traducción.
enzimas de síntesis se produce como sigue. Inicialmente, el ADN leer información sobre la enzima deseada para formar mRNA. El ARN mensajero codifica todos los aminoácidos que forman parte de la enzima. Regulación de las enzimas también puede ocurrir a nivel de ADN, si el producto de la reacción catalizada suficientes paradas de transcripción de genes y, por el contrario, si hay una necesidad en el producto, se activa el proceso de transcripción.
Una vez que el ARNm se libera en el citoplasma, la siguiente etapa – radiodifusión. En los ribosomas del retículo endoplásmico sintetizó la cadena principal que consiste en aminoácidos unidos por enlaces peptídicos. Sin embargo, la molécula de proteína en la estructura primaria aún no puede realizar su función enzimática.
La actividad enzimática depende de estructuras de proteínas. proteína mismos EPS se produce la torsión, formando de este modo primera estructura secundaria y luego terciaria. La síntesis de algunas enzimas se detiene en esta etapa, pero para mejorar la actividad del catalizador es a menudo de fijación necesaria y coenzima cofactor.
En ciertas áreas del retículo endoplásmico viene unida componentes orgánicos de la enzima: azúcares, ácidos nucleicos, grasas y vitaminas. Algunas enzimas no pueden funcionar sin la presencia de la coenzima.
Cofactor juega un papel crucial en la formación de la estructura cuaternaria de la proteína. Algunas de las funciones de las enzimas están disponibles sólo cuando la organización del dominio de la proteína. Por lo tanto es muy importante para su estructura presencia cuaternario en el que un enlace de conexión entre múltiples glóbulos de proteína es un ion metálico. 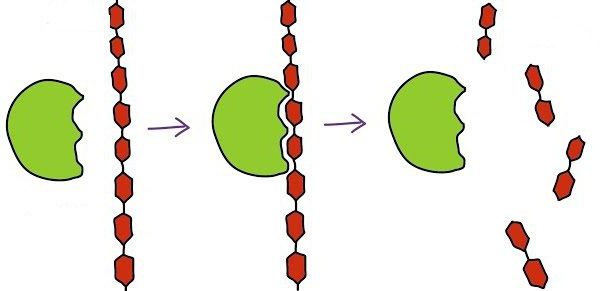
Múltiples formas de enzimas
Hay situaciones en las que es necesario la presencia de varias enzimas que catalizan la misma reacción, pero se diferencian entre sí en algunos aspectos. Por ejemplo, la enzima puede trabajar a 20 grados, pero a 0 grados, no va a ser capaz de realizar sus funciones. ¿Qué hacer en una situación así, el cuerpo vivo a bajas temperaturas?
Este problema se resuelve fácilmente por la presencia de varias enzimas que catalizan la misma reacción, pero en diferentes condiciones de trabajo. Hay dos tipos de formas múltiples de enzimas:
- Isoenzimas. Tales proteínas están codificadas por genes diferentes, que se componen de diferentes aminoácidos, pero catalizan la misma reacción.
- Los verdaderos múltiples formas. Estas proteínas se transcriben a partir del mismo gen, pero se produce en péptidos de modificación de los ribosomas. En la salida producido varias formas de la misma enzima.
Como resultado, múltiples formas del primer tipo se forma en el nivel genético, cuando el segundo – en el post-traduccional.
significado enzimas
El uso de enzimas en la medicina se reduce a la cuestión de los nuevos medicamentos, como parte de los cuales las sustancias que ya están en las cantidades adecuadas. Los científicos aún no han encontrado una manera de estimular la síntesis de enzimas que faltan en el cuerpo, pero es ahora ampliamente distribuido medicamentos que pueden compensar la duración de su desventaja.
Varias enzimas en una célula para catalizar gran número de reacciones relacionadas con el mantenimiento de la vida. Uno de estos representantes se enizmov nucleasas grupo: endonucleasa y exonucleasa. Su trabajo es mantener un nivel constante de ácidos nucleicos en una célula, la eliminación de ADN dañado y ARN.
No se olvide sobre el fenómeno de la coagulación de la sangre. Como una medida efectiva de la protección, el proceso es controlado por una serie de enzimas. El principal de ellos es la trombina, que convierte el fibrinógeno en fibrina proteína inactiva activa. Su hilo crea una especie de red que ocluye el sitio de la lesión del vaso, lo que impide la pérdida excesiva de sangre.
Las enzimas se utilizan en la elaboración del vino, la cerveza, la producción de muchos productos lácteos. Para el alcohol de la levadura la glucosa se puede utilizar, sin embargo, para la aparición éxito de este proceso y extraer suficiente de ellos. 
Datos interesantes sobre los que no sabían
– Todas las enzimas del cuerpo tienen una enorme masa – 5000 a 1.000.000 Da. Esto es debido a la presencia de proteína en la molécula. Para la comparación, el peso molecular de la glucosa – 180 Sí, y dióxido de carbono – un total de 44 Sí.
– Hasta la fecha, se abrió más de 2000 enzimas que se encuentran en las células de diversos organismos. Sin embargo, la mayoría de estas sustancias son todavía no se entiende completamente.
– La actividad enzimática se utiliza para la obtención de polvos de lavado eficaces. Aquí, las enzimas cumplen el mismo papel que en el cuerpo: descomponen la materia orgánica, y esta propiedad ayuda a los puntos de combate. Se recomienda el uso de un detergente tal a una temperatura de no más de 50 grados, de lo contrario puede ir al proceso de desnaturalización.
– Según las estadísticas, el 20% de las personas en todo el mundo sufren de la falta de cualquiera de las enzimas.
– Acerca de las propiedades de las enzimas conocidas desde hace mucho tiempo, pero sólo en 1897, la gente se dio cuenta de que no la levadura, y un extracto de sus células pueden ser utilizadas para la fermentación del azúcar en alcohol.















