Los compuestos de nitrógeno. propiedades de nitrógeno
Dar a luz a nitrato – según la traducción de la palabra latina Nitrogenium. Este nitrógeno título – un elemento químico con un número atómico de 7, la cabeza 15 de grupo en la versión larga de la tabla periódica. En la forma de una sustancia simple compuesta de la tierra distribuida bolsa de aire – atmósfera. Una variedad de compuestos de nitrógeno encontrado en la corteza terrestre, y los organismos vivos se usan ampliamente en las industrias, militar, la agricultura y la medicina.
¿Por qué se llama nitrógeno "asfixia" y "sin vida"
Como historiadores de la química sugieren consiguieron por primera vez esta sustancia simple Henry Cavendish (1777). Scientific pasa aire sobre carbones calientes para la absorción de los productos de reacción utilizando álcali. Como resultado de la experiencia investigadora encontrado gas incoloro e inodoro, el carbón sin reaccionar. Cavendish llamó "aire sofocante" de la incapacidad para mantener la respiración y la combustión.
Química moderna se explica que el oxígeno se hace reaccionar con carbón, se forma dióxido de carbono. El restante "sofocante" del aire era en su mayor parte de las moléculas de N 2. Cavendish y otros científicos en el tiempo sobre este asunto todavía no se conoce, aunque los compuestos de nitrógeno y nitrato a continuación, se utilizan ampliamente en la economía. El científico dijo sobre el gas inusual a un colega para llevar a cabo experimentos similares – Joseph Priestley.
Al mismo tiempo Carl Scheele llamó la atención sobre el componente desconocido del aire, pero no explicó adecuadamente su origen. Sólo Daniel Rutherford en 1772 se dio cuenta de que los presentes experimentos "asfixiante" "estropeado" gas – nitrógeno. Algunos científicos creen que su descubridor – que todavía se debate historiadores de la ciencia.

15 años después de los experimentos de Rutherford famoso químico Antuan Lavuaze propone sustituir el aire término "echado a perder" se refiere a nitrógeno, por el otro – Nitrogenium. En el momento en que se comprobó que esta sustancia no se quema, no es compatible respiración. Luego hubo el nombre ruso "nitrógeno", que se interpreta de diferentes maneras. A menudo dicen que significa el término "sin vida". Estudios posteriores han refutado la creencia generalizada acerca de las propiedades de las sustancias. Los compuestos de nitrógeno – proteínas – las principales macromoléculas en la composición de los organismos vivos. Con el fin de construir las plantas absorben de los elementos necesarios de nutrición mineral del suelo – 2- iones NO 3 y NH 4+.
Nitrógeno – un elemento químico
Para comprender la estructura y propiedades atómicas ayuda del sistema periódico (PS). La posición del elemento químico en la tabla periódica puede definir carga nuclear, número de protones y neutrones (número de masa). Es necesario prestar atención al valor de la masa atómica – esta es una de las principales características del elemento. período, el número corresponde al número de niveles de energía. La versión corta del número de la tabla periódica de grupo se corresponde con el número de electrones en el nivel energaticheskom externa. Resumiendo los datos de las características generales de nitrógeno por su posición en el sistema periódico:
- Este es un elemento no metálico se encuentra en la esquina superior derecha de la SS.
- símbolo químico: N.
- Número del alojamiento: 7.
- Masa atómica relativa: 14.0067.
- compuestos de hidrógeno volátiles fórmula: NH 3 (amoníaco).
- Forma un óxido superior N 2 O 5, que es igual a la valencia de V. nitrógeno
átomo de nitrógeno Estructura:
- 7 carga nuclear.
- El número de protones: 7; el número de neutrones: 7.
- Número de niveles de energía: 2.
- El número total de electrones: 7; e fórmula: 1s 2 2s 2 2p 3.
Detalles estudió isótopos estables № elemento 7, sus números de masa – 14 y 15. El contenido de un átomos ligeros de los cuales es 99,64%. Los núcleos de isótopo radiactivo de vida corta es también 7 protones, y el número de neutrones varía enormemente: 4, 5, 6, 9, 10.
El nitrógeno en la naturaleza
Como parte de las moléculas de aire son sustancia presente funda de tierra simple, cuya fórmula – N 2. El contenido de gas nitrógeno en la atmósfera es de aproximadamente 78,1% en volumen. Los compuestos inorgánicos del elemento químico en la corteza terrestre – diversas sales de amonio y nitratos (nitro). Los compuestos de la fórmula y los nombres de algunas de las sustancias más importantes:
- NH 3, amoníaco.
- NO dióxido de 2, nitrógeno.
- NaNO3 nitrato de sodio.
- (NH4) 2 SO4, sulfato de amonio.
La valencia del nitrógeno en los dos últimos compuestos – IV. Carbón, el suelo, los organismos vivos también contienen átomos de N en forma ligada. El nitrógeno es un componente de aminoácidos macromoléculas, ADN y nucleótidos de ARN, hormonas y hemoglobina. El contenido total del elemento químico en el cuerpo humano alcanza 2,5%.
sustancia simple
El nitrógeno en forma de moléculas diatómicas – el mayor volumen y peso del aire ambiente. Sustancias, cuya fórmula es N 2, no tiene olor, color y sabor. Este gas es más de 2/3 funda de tierra aire. El nitrógeno líquido es una sustancia incolora, se asemeja a agua. Hierve a una temperatura de -195,8 ° C. M (N 2) = 28 g / mol. Simple sustancia poco más fácil de oxígeno, nitrógeno, aire, su densidad es cercana a 1.
Los átomos en la molécula se unen firmemente 3 comparten pares de electrones. El compuesto exhibe una alta resistencia química, que lo distingue de oxígeno y otras sustancias gaseosas. Para una molécula de nitrógeno se divide en sus átomos constituyentes necesarios para gastar energía 942,9 kJ / mol. Contacto de los tres pares de electrones es muy fuerte, comienza a descomponerse cuando se calienta por encima de 2.000 ° C.
prácticamente no se produce bajo condiciones normales, la disociación de las moléculas en átomos. inercia química también es causada por nitrógeno completa ausencia de polaridad en su molécula. Ellos interactúan muy débilmente entre sí, trabajando de ese modo el estado gaseoso de la materia a presión normal y a una temperatura próxima a la temperatura ambiente. actividad química bajo de nitrógeno molecular se utiliza en diferentes procedimientos y dispositivos en los que es necesario para crear un ambiente inerte.
La disociación de las moléculas de N 2 se puede producir bajo la influencia de la radiación solar en la atmósfera superior. se forma nitrógeno atómico, que reacciona con ciertos metales y no metales en condiciones normales (fósforo, azufre, arsénico). El resultado es la síntesis de las condiciones del terreno sustancias que son obtenidos indirectamente.

valencia de nitrógeno
La capa de electrones exterior del átomo de formar un electrón 2 s 3 y p. Estos negativo de nitrógeno puede dar partículas al interactuar con otros elementos que corresponden a sus propiedades reductoras. Junto a la octeto que falta para átomo de electrones 3 exhibe capacidad oxidativa. La electronegatividad de nitrógeno por debajo de sus propiedades metálicas son menos pronunciada que la de flúor, oxígeno y cloro. Al interactuar con estos elementos químicos del nitrógeno da electrones (oxidan). Reducción de iones negativos seguido por reacción con otros metales y no metales.
valencia nitrógeno Típica – III. En este caso, los enlaces químicos se forman por la p-atracción exterior de electrones y la creación de par común (unión). El nitrógeno es capaz de formar enlace donador-aceptor debido a su par de electrones, como es el ion amonio NH 4+.
El conseguir en el laboratorio y la industria
métodos Uno de laboratorio basados en las propiedades oxidativas de óxido de cobre. Use compuesto de nitrógeno con hidrógeno – amoniaco NH 3. Esta desagradable olor vzaimoddeystvuet gas con polvo negro óxido de cobre. La reacción resultante produce nitrógeno y aparece cobre metálico (polvo rojo). Deposita sobre las paredes del tubo WATERDROPS – otro producto de reacción.
Otro método de laboratorio que utiliza un compuesto de nitrógeno con metales – azida, por ejemplo NaN 3. Se obtiene de un gas que no necesita ser limpiado de los contaminantes.
El laboratorio se lleva a la descomposición de nitrito de amonio a nitrógeno y agua. Para iniciar la reacción, se requiere calentamiento, a continuación, el proceso prosigue con desprendimiento de calor (exotérmica). El nitrógeno está contaminado con impurezas, por lo que se limpia y seca.
Preparación del nitrógeno en la industria:
- destilación fraccionada del aire líquido – un método, que utiliza las propiedades físicas de nitrógeno y oxígeno (diferente punto de ebullición);
- reacción química del aire con un carbón caliente;
- separación de gas por adsorción.
Interacción con los metales y de hidrógeno – propiedades oxidantes
moléculas duraderos inercia no permite algunos síntesis directa de compuestos de nitrógeno. Para activar los átomos necesarios para un fuerte calentamiento o sustancia irradiación. El nitrógeno puede reaccionar con litio a temperatura ambiente, con el magnesio, el calcio y el sodio, la reacción procede únicamente por calentamiento. se forman correspondientes nitruros metálicos.
La interacción de nitrógeno con hidrógeno se lleva a cabo a alta temperatura y presión. También este proceso requiere el catalizador. El amoníaco obtenido – uno de la síntesis química más importante. El nitrógeno, como un agente oxidante, muestra en sus tri negativo estados de oxidación:
- 3 (compuestos de amoniaco y otra nitrógeno, hidrógeno – nitruros);
- -2 (hidrazina N 2 H 4);
- -1 (hidroxilamina NH 2 OH).
El nitruro más importante – Amoniaco – preparado en grandes cantidades en la industria. El gran problema durante mucho tiempo se mantuvo la inercia química de nitrógeno. Sus fuentes de materias primas eran nitrato, pero las reservas de minerales comenzaron a declinar rápidamente con el crecimiento de la producción.

El gran logro de la ciencia y la práctica química ha sido la creación de la técnica de la fijación de nitrógeno de amoníaco a escala industrial. En las columnas especiales es por síntesis directa – un proceso reversible entre el nitrógeno obtenido a partir del aire y de hidrógeno. Al crear condiciones óptimas, desplaza el equilibrio de esta reacción para el lado del producto, usando el rendimiento de amoníaco del catalizador es 97%.
Interacción con oxígeno – propiedades reductoras
Con el fin de iniciar la reacción de nitrógeno y oxígeno, debe ser fuerte calentamiento. Poseen suficiente energía arco eléctrico y una descarga de rayo a la atmósfera. Los más importantes de compuestos inorgánicos en el que el nitrógeno está en sus estados de oxidación positivos:
- 1 (óxido de nitrógeno (I) N 2 O);
- 2 (NO de monóxido de nitrógeno);
- 3 (óxido de nitrógeno (III) N ácido nitroso 2 O 3, HNO 2, sales de nitrito de los mismos);
- 4 (dióxido de nitrógeno (IV) NO 2);
- 5 (pentóxido de nitrógeno (V) N 2 O 5, ácido nítrico HNO 3, nitratos).
El valor de origen natural
Las plantas absorben iones de amonio y aniones nitrato del suelo utilizado para la síntesis de las reacciones químicas de moléculas orgánicas en las células en constante funcionamiento. bacterias de los nódulos de nitrógeno atmosféricos pueden asimilar – entidades microscópicas formación de nódulos en las raíces de las leguminosas. Como resultado, este grupo de plantas recibió la batería requerida, se enriquece el suelo.
Durante las tormentas tropicales ocurrir reacción de oxidación del nitrógeno atmosférico. Los óxidos se disuelven para formar ácidos, estos compuestos de nitrógeno entran en el suelo en el agua. Debido al ciclo de los elementos en la naturaleza se reponen constantemente sus reservas en la corteza de la tierra, el aire. moléculas orgánicas complejas que contienen nitrógeno en su composición, son degradados por las bacterias en los componentes inorgánicos.
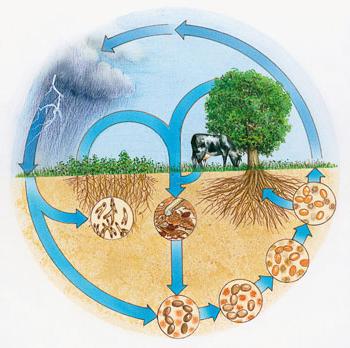
uso práctico
Los compuestos de nitrógeno más importantes para la agricultura – una sal altamente soluble. Absorbido por las plantas urea nitrato (sodio, potasio, calcio), compuestos de amonio (agua de amoniaco, cloruro, sulfato, nitrato de amonio).
Inerte propiedades nitrógeno plantas incapacidad para absorber desde el plomo fuera a la necesidad de hacer grandes dosis anualmente nitratos. Partes del organismo vegetal son capaces de almacenar energía macrocelda "para el futuro", que degrada la calidad del producto. El exceso de nitratos en las verduras y frutas pueden causar envenenamiento en humanos, el crecimiento de tumores malignos. Además de la agricultura, los compuestos de nitrógeno se utilizan en otras industrias:
- para la preparación de medicamentos;
- para la síntesis química de los compuestos de alto peso molecular;
- en la fabricación de explosivos de trinitrotolueno (TNT);
- para la producción de colorantes.
NO óxido encuentra uso en la cirugía, la sustancia tiene un efecto analgésico. La pérdida de sensibilidad cuando el gas inhalado se dio cuenta de que incluso los primeros investigadores de nitrógeno propiedades químicas. Por lo que no era un nombre común "gas de la risa".
El problema de los nitratos en los productos agrícolas
Las sales de ácido nítrico – Nitrato – contenían un anión con una sola carga NO 3-. Todavía se utiliza el antiguo nombre del grupo de sustancias – nitrato de amonio. Los nitratos se utilizan para fertilizar los campos, en los invernaderos, jardines. Llevarlos a principios de primavera antes de la siembra, en el verano – en la forma de alimentación de líquido. Por sí mismos, la sustancia no representa un gran peligro para las personas, sino en el cuerpo, que se convierten en nitritos y luego en nitrosaminas. El nitrito NO 2- iones – partículas tóxicas, que causan la oxidación de hierro ferroso en las moléculas de hemoglobina en los iones trivalentes. En este estado, la sustancia principal de la sangre humana y animal no es capaz de transportar oxígeno y eliminar dióxido de carbono de los tejidos.
La contaminación por nitratos de los alimentos más peligrosos para la salud humana:
- tumores malignos que surgen en la conversión de nitratos a las nitrosaminas (cancerígenos);
- el desarrollo de la colitis ulcerosa,
- hipotensión o hipertensión;
- insuficiencia cardíaca;
- trastornos de la coagulación
- lesiones del hígado, el páncreas y el desarrollo de la diabetes;
- desarrollo de la insuficiencia renal;
- anemia, alteraciones de la memoria, la atención y la inteligencia.
El uso simultáneo de diferentes productos con grandes dosis de nitratos conduce a la intoxicación aguda. Las fuentes pueden ser plantas, agua potable, platos de carne preparados. El remojo en agua limpia y cocinar puede reducir el contenido nutricional de los productos de nitrato. Los investigadores encontraron que dosis más altas de compuestos peligrosos observaron en la producción inmaduros y planta de invernadero.

Fósforo – elemento pnictógeno
Los átomos de elementos químicos que están en la misma columna vertical del sistema periódico, exhiben propiedades comunes. El fósforo se encuentra en el tercer período, se refiere al grupo 15, así como nitrógeno. elementos de estructura átomos similares, pero hay diferencias en las propiedades. El nitrógeno y el fósforo exhiben valencia y la oxidación estado negativo III en sus compuestos con metales y de hidrógeno.
Muchas reacciones de fósforo proceden a temperaturas ordinarias, un elemento químicamente activo. Se hace reaccionar con el oxígeno para formar P 2 O 5 superior de óxido. La solución acuosa de este material tiene las propiedades de ácido (metafosfórico). Si bien el calentamiento de ácido ortofosfórico se obtiene. Se define una pluralidad de tipos de sales, muchos de los cuales son los fertilizantes minerales, por ejemplo superfosfatos. Los compuestos de nitrógeno y fósforo forman una parte importante del ciclo de materia y energía en nuestro planeta, que se utiliza en los campos industriales, agrícolas y otros.