Nomenclatura Internacional de alcanos. Alcanos: estructura, propiedades
Es útil comenzar con una definición de los alcanos. Este saturado o saturado hidrocarburos, parafinas. También podemos decir que los carbonos en el que los átomos compuesto C se lleva a cabo por medio de las relaciones simples. La fórmula general es de la forma: CnH₂n + 2.
Se sabe que la relación de átomos de H y C en sus moléculas como sea posible en comparación con otras clases. Dado que todas las valencias están ocupados o C, o H, y las propiedades químicas de alcanos expresaron brillantemente suficiente, por lo que su segundo nombre sobresale frase límite o hidrocarburos saturados.
también hay un nombre más antiguo que mejor refleja su relativa himinertnost – parafinas, que traducido significa "falta de afinidad".
Por lo tanto, el tema de conversación del día de hoy: "Alka: homóloga serie, nomenclatura, estructura, isomería". También presentará los datos en cuanto a sus propiedades físicas.
Alcanos: estructura, nomenclatura
En estos átomos de C están en un estado tal como sp3-hibridación. Por lo tanto molécula de alcano se puede demostrar como un conjunto de estructuras tetraédrica C, que están conectados, no sólo entre sí sino también con H. 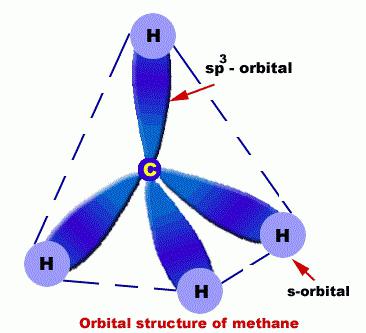
Entre los átomos de C y H están presentes, muy baja polar s-unión duradera. Los átomos alrededor de enlaces sencillos siempre giran como consecuencia de alcanos moléculas adoptan diferentes formas, en el que la longitud de la conexión, el ángulo entre ellos – son constantes. Formas, que se transforman una en la otra debido a la rotación de la molécula, que se produce alrededor de los sigma-bonos, se refiere como su conformación. 
En el proceso de desprendimiento de los átomos de H de la molécula forma un partículas 1-valentes llamadas radicales de hidrocarburos. Estos compuestos son el resultado no sólo de compuestos orgánicos , pero también inorgánicos. Si reste de dos átomos de hidrógeno a partir de un límite molécula de hidrocarburo, se obtiene los radicales 2-valencia.
Por lo tanto alcanos pueden ser nomenclatura:
- radial (versión antigua);
- Sustitución (internacional, sistemática). Propuso por la IUPAC.
nomenclatura Especialmente radial
En el primer caso alcanos nomenclatura se caracterizan como sigue:
- hidrocarburos consideración como derivados de metano, que está sustituido por 1 o más átomos de H radicales.
- El alto grado de comodidad en el caso de compuestos no muy complejas.
Características de la nomenclatura de sustitución
alcano nomenclatura Sustitución tiene las siguientes características:
- La base para el nombre – 1 la cadena de carbono, y los fragmentos moleculares restantes se consideran como sustituyentes.
- Si hay varios radicales idénticos antes de su nombre indica el número (estrictamente en palabras), y los números de radicales separados por comas.
Química: nomenclatura de alcanos
Para mayor comodidad, la información se presenta en forma de tabla.
|
Nombre de la sustancia |
La base del nombre (raíz) |
fórmula molecular |
Adjunto Nombre de carbono |
sustituyente de carbono Fórmula |
|
metano |
metanfetamina |
CH₄ |
metilo |
CH₃ |
|
etano |
etno |
C₂H₆ |
etilo |
C₂H₅ |
|
propano |
apuntalar |
C₃H₈ |
propilo |
C₃H₇ |
|
butano |
pero- |
C₄H₁₀ |
butilo |
C₄H₉ |
|
pentano |
encerrado |
C₅H₁₂ |
pentilo |
C₅H₁₁ |
|
hexano |
maleficio |
C₆H₁₄ |
hexilo |
C₆H₁₃ |
|
heptano |
hept |
C₇H₁₆ |
heptilo |
C₇H₁₅ |
|
octano |
octubre |
C₈H₁₈ |
octil |
C₈H₁₇ |
|
nonano |
n en |
C₉H₂₀ |
nonil |
C₉H₁₉ |
|
decano |
dextrano |
C₁₀H₂₂ |
decilo |
C₁₀H₂₁ |
Los alcanos nomenclatura anteriores incluyen nombres históricamente están formados (los primeros 4 términos de los hidrocarburos saturados de la serie).
alcanos Aquí nondeployed con 5 o más C formados a partir de los átomos de números griegos que reflejan un número dado de átomos de C. Por lo tanto sufijo -en indica que la sustancia de un número de compuestos saturados. 
En la elaboración de títulos desplegados alcanos como la cadena principal se selecciona la que contiene el número máximo de átomos de C. Se numera de forma que los sustituyentes tienen el número más pequeño. En el caso de dos o más cadenas de igual longitud se convierte en el principal que contiene el mayor número de sustituyentes.
isomería de alcanos
Como hidrocarburo-fundador de una serie de actos metano CH $ ₄ $. Con cada representante de la serie del metano observado en contraste con el grupo de metileno anterior – CH $ ₂ $. Este patrón se puede rastrear través de la serie de alcanos.
científico alemán Schill presentó una propuesta para nombrar el número de homólogos. Traducida del griego y significa "similares, como".
Por lo tanto, la homóloga serie – un conjunto de compuestos orgánicos relacionados que tienen el mismo tipo de estructura con cerca himsvoystvami. Homólogos – los miembros de la serie. Homóloga diferencia – grupo metileno por el cual los dos homólogo adyacente diferente.
Como se mencionó anteriormente, cualquier composición de la hidrocarburo saturado se puede expresar por la fórmula general CnH₂n + 2. De este modo, siguiendo el metano es un miembro de la serie homóloga de etano – C₂H₆. Para deducir la estructura de metano, es necesario reemplazar el átomo de H en el 1 CH $ ₃ $ (figura siguiente). 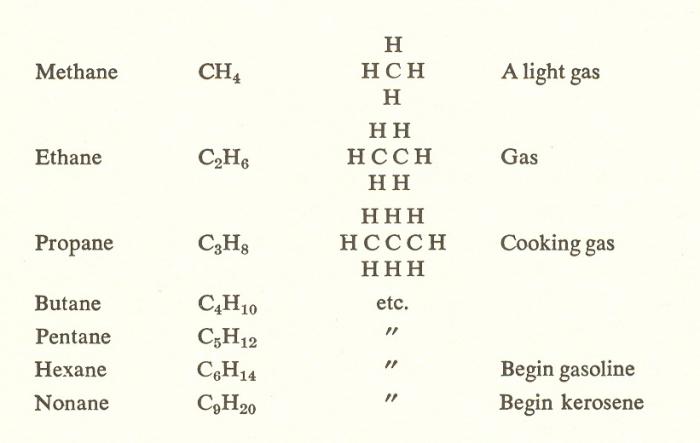
La estructura de cada homólogo posterior se puede derivar de la anterior de la misma manera. Como resultado de etano formado propano – C₃H₈.
¿Cuáles son los isómeros?
Son sustancias que tienen una composición idéntica cualitativa y cuantitativa molecular (fórmula molecular idéntica), pero diferentes estructuras químicas y tener diferente himsvoystvami.
Caracterizado por los hidrocarburos anteriormente mencionados en tal parámetro como la temperatura de ebullición: -0,5 ° – butano, -10 ° – isobutano. Este tipo de isomería refiere isomería esqueleto como carbonoso, se refiere al tipo estructural.
El número de isómeros estructurales aumenta rápidamente con el número de átomos de carbono. Por lo tanto, C₁₀H₂₂ corresponderá isómeros 75 (no incluyendo el espacio), y para 4347 C₁₅H₃₂ isómeros ya conocidos, por C₂₀H₄₂ – 366.319.
Así que ya estaba claro que un alcanos, series homólogas, isomería, tal nomenclatura. Ahora bien, es necesario acudir a las reglas de nombres de la IUPAC. 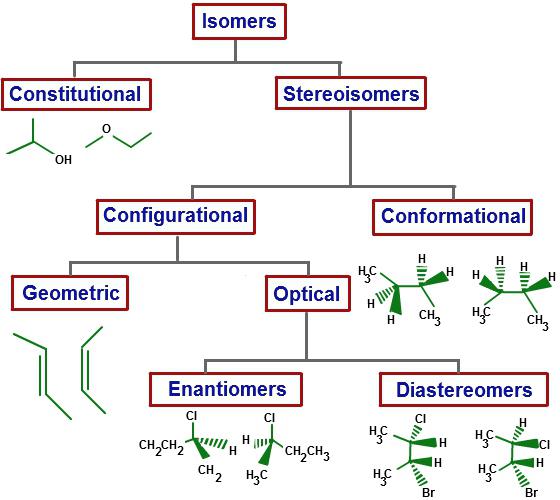
Nomenclatura IUPAC: El nombre de la educación
En primer lugar, es necesario encontrar una estructura de una cadena de carbono de hidrocarburo, que contiene la mayoría de la longitud y el número máximo de sustituyentes. A continuación, el número requerido de la cadena de átomos de C, partiendo desde el extremo, que es el sustituyente más cercano.
En segundo lugar, la base – el nombre del hidrocarburo saturado no ramificado, que corresponde al número de átomos de C es la cadena principal.
En tercer lugar, antes de la fundación debe especificar lokantov habitaciones, que se encuentran cerca de los Diputados. Fueron escritas suplentes apellido compuesto.
En cuarto lugar, en caso de sustituyentes idénticos en diferentes átomos de C lokanty juntos, en el que antes de que el nombre aparece multiplica prefijo: di – dos sustituyentes idénticos tres – a tres, tetra – cuatro, penta – a cinco, etc. Figuras .. ellos deben estar separados por una coma, y de las palabras – guión.
Si uno y el mismo átomo de C contenía sólo dos sustituyentes lokant también registró dos veces.
De acuerdo con estas reglas, y formó una nomenclatura internacional de alcanos. 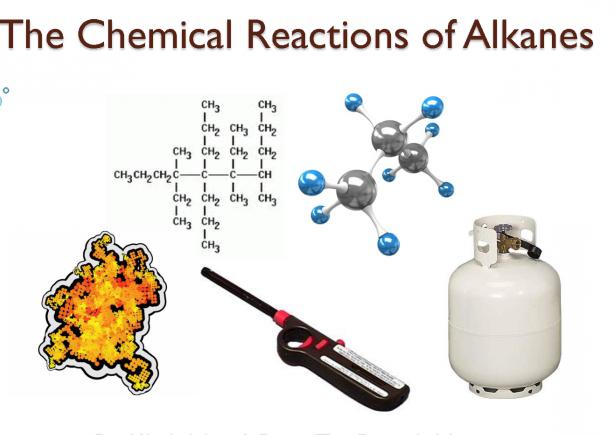
La proyección de Newman
Este científico estadounidense sugiere para conformaciones demostración gráfica fórmula de proyección especial – proyección de Newman. Se corresponden con las formas A y B y C se muestran en la siguiente figura. 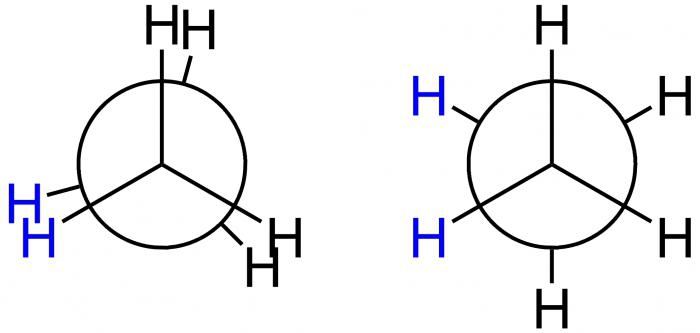
En el primer caso de la conformación eclipsada-A, mientras que el segundo – B-inhibida. En la posición de los átomos A H se encuentran a una distancia mínima entre sí. Esta forma se corresponde con el valor más grande de la energía debida al hecho de que la mayor repulsión entre los mismos. Este estado energéticamente desfavorable, con lo que la molécula tiende a dejar, y moverse a una posición más estable B. Aquí los átomos de H de la distancia máxima entre sí. Por lo tanto, la diferencia de energía de estas disposiciones – 12 kJ / mol, de modo que la rotación libre alrededor del eje de la molécula de etano, que conecta los grupos metilo obtiene desigual. Una vez en la posición energéticamente favorable de la molécula no se retrasa, en otras palabras, el "freno". Es por eso que se llama retardada. Resultado -. 10 mil moléculas de etano son en la forma de conformación proporcionado temperatura ambiente inhibido. Sólo uno tiene una forma diferente – eclipsado.
Preparación de hidrocarburos saturados
Desde el artículo se supo que esta alcanos (estructura, nomenclatura de ellos descritos en detalle anteriormente). Sería superfluo examinar sus métodos de preparación. Se extraen de fuentes naturales tales como aceite, gas natural, gas asociado, el carbón. También se aplican métodos de síntesis. Por ejemplo, H $ ₂ $ 2H₂:
- El proceso de hidrogenación de hidrocarburos insaturados: CnH₂n (alquenos) → CnH₂n + 2 (alcanos) ← CnH₂n-2 (alquinos).
- Monóxido de una mezcla de C y H – gas de síntesis: nCO + (2n + 1) H₂ → CnH₂n + 2 + nH₂O.
- A partir de ácidos carboxílicos (sales de los mismos): la electrólisis en el ánodo al cátodo:
- Kolbe electrólisis: 2RCOONa + 2H₂O → R-R + 2CO₂ + H₂ + 2NaOH;
- reacción Dumas (aleación con álcali): + NaOH CH₃COONa (t) → CH $ ₄ $ + Na₂CO₃.
- Craqueo de petróleo: CnH₂n + 2 (450-700 °) → CmH₂m + 2 + Cn-mH₂ (nm).
- La gasificación de combustible (sólido): C + 2H₂ → CH $ ₄ $.
- Síntesis de alcanos complejos (halogenados) que tienen un número mínimo de átomos de C: 2CH₃Cl (clorometano) + 2Na → CH $ ₃ $ CH $ ₃ $ (etano) + 2NaCl.
- methanide Expansión agua (carburos metálicos): Al₄C₃ + 12H₂O → 4Al (OH₃) ↓ + 3CH₄ ↑.
Las propiedades físicas de hidrocarburos saturados
Para mayor comodidad, los datos se agrupan en la tabla.
|
fórmula |
alcano |
El punto de fusión en ° C |
El punto de ebullición en ° C |
Densidad, g / ml |
|
CH₄ |
metano |
-183 |
-162 |
0,415 en t = -165 ° C |
|
C₂H₆ |
etano |
-183 |
-88 |
0,561 en t = -100 ° C |
|
C₃H₈ |
propano |
-188 |
-42 |
0,583 en t = -45 ° C |
|
n-C₄H₁₀ |
n-butano |
-139 |
-0.5 |
0,579 en t = 0 ° C |
|
2-metilpropano |
– 160 |
– 12 |
0,557 en t = -25 ° C |
|
|
2,2-dimetil-propano |
– 16 |
9.5 |
0613 |
|
|
n-C₅H₁₂ |
n-pentano |
-130 |
36 |
0,626 |
|
2-metilbutano |
– 160 |
28 |
0620 |
|
|
n-C₆H₁₄ |
n-Hexano |
– 95 |
69 |
0,660 |
|
2-metilpentano |
– 153 |
62 |
0,683 |
|
|
n-C₇H₁₆ |
n-heptano |
– 91 |
98 |
0,683 |
|
n-C₈H₁₈ |
n-octano |
– 57 |
126 |
0,702 |
|
2,2,3,3-tetra-metil-butano |
– 100 |
106 |
0656 |
|
|
2,2,4-trimetil-pentano |
– 107 |
99 |
0,692 |
|
|
n-C₉H₂₀ |
n-Nonano |
– 53 |
151 |
0718 |
|
n-C₁₀H₂₂ |
n-decano |
– 30 |
174 |
0,730 |
|
n-C₁₁H₂₄ |
n-undecano |
– 26 |
196 |
0,740 |
|
n-C₁₂H₂₆ |
n-dodecano |
– 10 |
216 |
0,748 |
|
n-C₁₃H₂₈ |
n-tridecano |
– 5 |
235 |
0756 |
|
n-C₁₄H₃₀ |
n-tetradecano |
6 |
254 |
0,762 |
|
n-C₁₅H₃₂ |
n-pentadecano |
10 |
271 |
0,768 |
|
n-C₁₆H₃₄ |
n-hexadecano |
18 |
287 |
0,776 |
|
n-C₂₀H₄₂ |
n-eicosano |
37 |
343 |
0,788 |
|
n-C₃₀H₆₂ |
n-Triakontan |
66 |
235 con 1 mm Hg. artículo |
0,779 |
|
n-C₄₀H₈₂ |
n-Tetrakontan |
81 |
260 con 3 mm Hg. Art. |
|
|
n-C₅₀H₁₀₂ |
n-Pentakontan |
92 |
a 420 15 mm Hg. Art. |
|
|
n-C₆₀H₁₂₂ |
n-Geksakontan |
99 |
||
|
n-C₇₀H₁₄₂ |
n-Geptakontan |
105 |
||
|
n-C₁₀₀H₂₀₂ |
n-Gektan |
115 |
conclusión
El artículo fue considerado una cosa tal como alcanos (estructura, nomenclatura, isomería, serie homóloga y así sucesivamente.). Nos dice un poco acerca de las características de radiales y de sustitución de nomenclaturas. Se describen procedimientos para la obtención de alcanos.
Además, el artículo enumerado en detalle toda la nomenclatura de alcanos (prueba puede ayudar a asimilar la información).
















