En la naturaleza existen muchos átomos en forma ligada, formando una combinación especial, llamado moléculas. Sin embargo, los gases inertes, que justifica su nombre, forman unidades monoatómicos. El molecular estructura de la materia por lo general implica enlaces covalentes. Pero hay también de los llamados condicionalmente interacciones débiles entre los átomos. Las moléculas pueden ser enormes, compuesto de millones de átomos. ¿Dónde está hay una estructura molecular tan compleja? Ejemplos – una pluralidad de sustancias orgánicas, tales como proteínas y estructura cuaternaria de ADN.
 sin productos químicos
sin productos químicos
Los enlaces covalentes que mantienen unidos a los átomos, es extremadamente fuerte. Pero las propiedades físicas de una sustancia dependen de este, que dependen de las fuerzas de van der Waals y enlaces de hidrógeno, que proporcionan la interacción entre las estructuras adyacentes de los fragmentos entre sí. La estructura molecular de un líquido, gas o sustancias sólidas legkoplavyaschihsya explica el estado de agregación, en el que se observa ellos a una cierta temperatura. Para cambiar el estado de la materia, sólo tiene que calentar o enfriar. Los enlaces covalentes no está roto.
Los límites del proceso de inicio
¿Qué tan alto o bajo puntos será de gasificación y fusión? Depende de la fuerza de las interacciones intermoleculares. Los enlaces de hidrógeno en la sustancia aumentó la temperatura cambia de estado agregado. Cuanto más grande es la molécula, más sus interacciones de van der Waals, más difícil es hacer que un gas líquido o líquido sólido.
Características de amoníaco
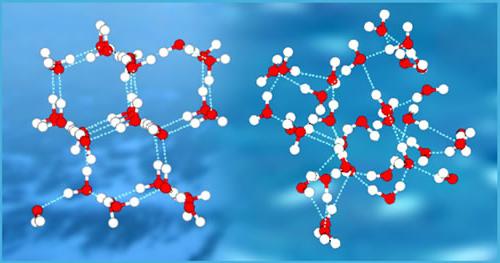 La mayoría de las sustancias conocidas, no es soluble en agua en absoluto. Y aquellos que todavía se disuelva, interactuar, a menudo con la formación de nuevos enlaces de hidrógeno. Ejemplo – amoníaco. Él es capaz de romper los enlaces de hidrógeno entre las moléculas de agua y con éxito construir su propio. En paralelo, la reacción de intercambio de iones, pero no juega un papel importante en la disolución de amoníaco. Básicamente amoníaco deberá enlaces de hidrógeno de este proceso. La reacción es la misma en ambas direcciones, el proceso puede, bajo cierta temperatura y presión generalmente en equilibrio. Otras sustancias solubles, tales como el etanol y el azúcar, también perfectamente ligados c agua por medio de interacciones intermoleculares.
La mayoría de las sustancias conocidas, no es soluble en agua en absoluto. Y aquellos que todavía se disuelva, interactuar, a menudo con la formación de nuevos enlaces de hidrógeno. Ejemplo – amoníaco. Él es capaz de romper los enlaces de hidrógeno entre las moléculas de agua y con éxito construir su propio. En paralelo, la reacción de intercambio de iones, pero no juega un papel importante en la disolución de amoníaco. Básicamente amoníaco deberá enlaces de hidrógeno de este proceso. La reacción es la misma en ambas direcciones, el proceso puede, bajo cierta temperatura y presión generalmente en equilibrio. Otras sustancias solubles, tales como el etanol y el azúcar, también perfectamente ligados c agua por medio de interacciones intermoleculares.
otras causas
Solubilidad en líquidos orgánicos se proporciona mediante la formación de enlaces de van der Waals. interacción adecuada disolvente de por lo tanto destruido. moléculas de soluto se unen a él para formar una mezcla homogénea en apariencia. Muy muchos procesos vitales han sido posibles gracias a estas propiedades de las sustancias orgánicas.
Toku – sin
¿Por qué la mayoría de las sustancias no conduce la electricidad? Estructura molecular no permite! Para el movimiento simultáneo de la necesidad actual de un gran número de electrones, una especie de "granja" de ellos. Esto es lo que ocurre en metales, no metales, pero casi nunca han sucede. En el límite respecto de las propiedades son materiales semiconductores que tienen una conductividad depende del entorno.

Un gran número de procesos físicos se pueden explicar fácilmente, si hay información acerca de la estructura molecular de la sustancia. estados de agregación son bien entendidos por la física moderna.















