propiedades químicas de los metales alcalinotérreos. El uso de metales de tierras alcalinas. Propiedades físicas del metal alcalinotérreo
Tenga en cuenta las propiedades químicas de los metales de tierras alcalinas. Definir las características de su estructura, recibiendo, al estar en la naturaleza, de la aplicación.
La situación en la SS
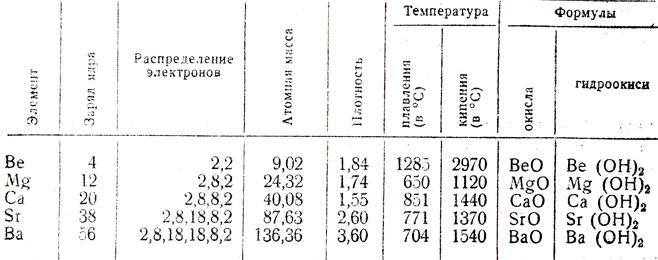
Para definir la ubicación de inicio de estos elementos en la tabla periódica de Mendeleiev. Están ubicados en el segundo grupo de los principales subgrupos. Estos incluyen calcio, estroncio, radio, bario, magnesio, berilio. Todos ellos están en el nivel de energía externa contiene dos electrones de valencia. En términos generales, berilio, magnesio y metales alcalinotérreos son externamente electrones NS2. Los compuestos químicos, ya que muestran el estado de oxidación +2. Durante la interacción con otras sustancias, que presentan propiedades de reducción, dando electrones de un nivel de energía externa.

Cambio de propiedades
Con el aumento de átomo de berilio núcleo, magnesio y metales alcalinotérreos mejorar sus propiedades metálicas, ya que hay un aumento en el radio de sus átomos. Tenga en cuenta las propiedades físicas de los metales alcalinotérreos. El berilio es en el estado normal es un metal con un gray luster acero. Tiene una densa red cristalina hexagonal. En contacto con el oxígeno, berilio formar inmediatamente una película de óxido, reduciendo de este modo su reactividad, recubrimiento mate formado.
propiedades físicas
Magnesio como una sustancia simple es un metal blanco que forma el recubrimiento de óxido en el aire. Tiene una red cristalina hexagonal.
Propiedades físicas del calcio metales alcalinotérreos, bario, estroncio similares. Representan metales típicos con brillo plateado, cubrir bajo la influencia de la película de color amarillento oxígeno del aire. En calcio y red cúbica centrada en la cara de estroncio, de bario tiene una estructura centrada en el cuerpo.
alcalina Química de metal tierra basado en el hecho de que tienen una naturaleza metálica de la relación. Es por eso que se caracterizan por una alta conductividad eléctrica y térmica. Las temperaturas de puntos de fusión y de ebullición mayor que el de los metales alcalinos.

Métodos para la preparación
producción de berilio en una escala industrial se lleva a cabo por reducción del fluoruro de metal. La condición del flujo de la reacción química es la de precalentamiento.
Dado que en la naturaleza los metales de tierras alcalinas están en forma de compuestos para el magnesio, estroncio, calcio conducta electrólisis de masas fundidas de sus sales.

propiedades químicas
propiedades químicas de los metales alcalinotérreos están asociados con la necesidad de eliminar antes de su superficie una capa de película de óxido. Se determina la inercia de estos metales al agua. Calcio, bario, estroncio, cuando se disuelve en agua para formar hidróxidos de haber pronunciado propiedades básicas.
Propiedades químicas de los metales de tierras alcalinas asumen su interacción con el oxígeno. Al producto de reacción de peróxido de bario es, para todos los otros óxidos formados después de la reacción. Todos los miembros de esta clase de óxidos presentan propiedades básicas, sólo óxido de berilio propiedades características anfóteros.
Propiedades químicas de los metales de tierras alcalinas se muestran y en la reacción con azufre, halógeno, nitrógeno. Cuando se observa la reacción con una disolución de ácido de estos elementos. Dado que el berilio se refiere a elementos anfóteros, es capaz de reaccionar químicamente con los álcalis.

reacciones cualitativas
fórmulas básicas de metales alcalinotérreos, vistos en el curso de la química inorgánica asociada con sales. Para identificar los miembros de esta clase en combinación con otros elementos, puede utilizar la determinación cualitativa. Cuando se aplica la sal de metal alcalinotérreo en llama de alcohol-lámpara, tinción llama observó cationes. cationes de estroncio da una tonalidad de color rojo oscuro, el catión de calcio – catión tono de bario naranja y verde.
Para identificar catión de bario usado en aniones sulfato análisis cualitativos. Como resultado de esta reacción de un sulfato de bario blanco que es insoluble en ácidos minerales.
El radio es un elemento radiactivo que contiene en la naturaleza en cantidades menores. Cuando se hace reaccionar magnesio con oxígeno, hay un destello brillante. Este proceso se utiliza durante algún tiempo mientras toma imágenes en lugares oscuros. Ahora sustituir el flash de magnesio llegó el sistema eléctrico. La familia de los metales de tierras alcalinas se refiere berilio, que se hace reaccionar con muchas sustancias químicas. El calcio y el magnesio y aluminio de manera similar, se pueden recuperar los metales raros, tales como titanio, tungsteno, molibdeno y niobio. Estos procesos para la obtención de metales refiere kaltsietermiey y magnietermiey.

Características de la aplicación
¿Cuál es el uso de metales de tierras alcalinas? El calcio y el magnesio se utilizan para la fabricación de aleaciones ligeras y metales raros.
Por ejemplo, el magnesio está contenido en la composición de duraluminio, y calcio – un componente de aleaciones de plomo usados para preparar las cubiertas de cables y la creación de cojinetes. utiliza extensamente de metal alcalinotérreo en la técnica en forma de óxidos. La cal apagada (óxido de calcio) y quemado de magnesio (óxido de magnesio) se requieren para el sector de la construcción.
En la reacción de óxido de calcio con agua se libera cantidades significativas de calor. se utiliza cal apagada (hidróxido de calcio) para la construcción. La suspensión blanca de la sustancia (lechada de cal) se utiliza en la industria del azúcar para el proceso de purificación de zumo de remolacha.
Las sales de metales del segundo grupo
sales de magnesio, berilio, metales de tierras alcalinas se pueden preparar por reacción con ácidos de los respectivos óxidos. Cloruros, fluoruros, yoduros de datos elementos son compuestos cristalinos blancos, generalmente bien soluble en agua. Entre los sulfatos de tener una solubilidad solamente de magnesio y el compuesto de berilio. Se aprecia una disminución a partir de sales de berilio de sulfato de bario. Los carbonatos son prácticamente insolubles en agua o tener una solubilidad mínima.
Los sulfuros de elementos de tierras alcalinas están contenidas en pequeñas cantidades en metales pesados. Si se le envía a la luz, se puede obtener una variedad de colores. Los sulfuros se incluyen en las composiciones luminiscentes, llamado fósforos. Aplicar estos colores para crear marcaciones luminosas, señales de tráfico.
compuestos comunes de metales alcalinotérreos
El carbonato de calcio es el elemento más abundante en la superficie de la tierra. Es parte de compuestos tales como piedra caliza, mármol, creta. Entre ellos, el uso principal es de piedra caliza. Este mineral es indispensable en la construcción, se considera una excelente piedra de construcción. Además, los presentes compuestos son la cal viva inorgánico y cal apagada, vidrio y cemento.
El uso de grava caliza contribuye a la carretera, pero debido a que el polvo puede reducir la acidez del suelo. tiza Natural es una cáscara animales más viejos. Este compuesto se usa para la fabricación de caucho, papel, creando lápices de colores de la escuela.
la demanda de mármol de arquitectos, escultores. Está hecho de mármol se crearon muchas obras únicas de Miguel Ángel. Parte de las estaciones del metro de Moscú está revestido con baldosas de mármol. carbonato de magnesio se utiliza en grandes cantidades en la fabricación de ladrillos, cemento, vidrio. Se necesita en la industria metalúrgica para la eliminación de residuos de roca.
sulfato de calcio contenida naturalmente en forma de yeso (sulfato de calcio cristalino) se utiliza en la industria de la construcción. En medicina, el compuesto se utiliza para la producción de moldes, y para producir vendas de yeso.
Estuco (yeso hemihidrato) por reacción con el agua liberando enormes cantidades de calor. También se utiliza en la industria.
sal de Epsom (sulfato de magnesio), utilizado en la medicina como laxante. Esta sustancia tiene un sabor amargo, que se encuentra en el agua de mar.
"Gachas Barita" (sulfato de bario) no es soluble en agua. Es por ello que esta sal se utiliza en radiología. Sal sostiene los rayos X que pueden detectar las enfermedades del tracto gastrointestinal.
La composición de la roca de fosfato (rock) y fosfato de calcio es apatita. Tienen que producir compuestos de calcio: óxidos, hidróxidos.
El calcio juega para los organismos que viven de particular importancia. Es este metal es esencial para la construcción de esqueleto del hueso. Se requieren iones de calcio para el ajuste del corazón, aumentar la coagulación de la sangre. La falta de causa un mal funcionamiento del sistema nervioso, pérdida de la coagulación, la pérdida de la capacidad de entregar normalmente mantienen una variedad de artículos.
Con el fin de evitar problemas de salud, cada día debe consumir alrededor de 1,5 gramos de calcio. El principal problema radica en el hecho de que al cuerpo a absorber el calcio de 0,06 gramos debe comer 1 gramo de grasa. La cantidad máxima de metal contenido en lechuga, perejil, queso cottage, queso.

conclusión
Todos los representantes del segundo grupo de la tabla periódica del subgrupo principal necesaria para la vida y el trabajo del hombre moderno. Por ejemplo, el magnesio es un estimulador de los procesos metabólicos en el cuerpo. Debe estar presente en el tejido nervioso, sangre, hueso, hígado. El magnesio es un participante activo y la fotosíntesis en las plantas, ya que es parte de la clorofila. Los huesos humanos son alrededor de un quinto del peso total. Que contienen calcio y magnesio. Óxidos, sales de metales alcalinotérreos han encontrado diversas aplicaciones en la industria de la construcción, industria farmacéutica y de la medicina.