Una de las definiciones de la vida, es el siguiente: "La vida es el modo de existencia de cuerpos proteicos." En nuestro planeta, sin excepción organismos contienen materiales tales orgánicos, tales como proteínas. Este artículo describirá las proteínas simples y complejas diferencias en la estructura molecular identificados, y discute sus funciones en la célula.
¿Cuáles son las proteínas
Desde el punto de vista de la bioquímica – polímeros orgánicos un alto peso molecular, monómeros que son 20 tipos diferentes de aminoácidos. Ellos se unen entre sí por enlaces químicos covalentes, péptido conocido de otra manera. Desde monómeros de proteínas son compuestos anfóteros, que contienen tanto un grupo amino y un grupo funcional carboxilo. Enlace químico CO-NH entre ellos se produce.
Si el polipéptido consiste en los residuos de aminoácidos enlaces, se forma una proteína simple. Las moléculas del polímero, que comprende además iones de metales, vitaminas, nucleótidos, hidratos de carbono – son proteínas complejas. A continuación, tenemos en cuenta la estructura espacial de los polipéptidos.
Los niveles de organización de las moléculas de proteínas
Se presentan en cuatro configuraciones diferentes. La primera estructura – lineal, que es la más simple y tiene la forma de una cadena de polipéptido durante su espiral la formación de enlaces de hidrógeno adicionales. Estabilizan la hélice, que se llama una estructura secundaria. Las instituciones terciarias tienen proteínas simples y complejos, la mayoría de las células vegetales y animales. La configuración de este último – cuaternario surge en la interacción de varias moléculas de la estructura nativa, coenzimas unidos, a saber, tales proteínas tienen una estructura compleja, operan en varias funciones del cuerpo.
Una variedad de proteínas simples
Este grupo no es numerosos polipéptidos. Sus moléculas consisten solamente en restos de aminoácidos. Para incluir proteínas, tales como las histonas y globulinas. La primera representados en la estructura de núcleo, y se combinan con las moléculas de ADN. El segundo grupo – globulinas – son los principales componentes del plasma sanguíneo. una proteína tal como gamma globulina, realiza las funciones de la defensa inmune y es un anticuerpo. Estos compuestos pueden formar complejos, que contienen hidratos de carbono complejos y proteínas. Tales proteínas simples fibrilares tales como el colágeno y la elastina, son parte de la del tejido conectivo, cartílago, tendones, piel. Su función principal – la construcción y apoyo.
proteína tubulina es un miembro de los microtúbulos, que son componentes de los cilios y flagelos organismos unicelulares tales como ciliados, Euglena, flagelados parasitarias. Esta misma proteína es un miembro de los organismos multicelulares (espermatozoides flagelos, cilios óvulos, epitelio ciliado del intestino delgado).
proteína albúmina sirve para almacenar una función (por ejemplo, una proteína de los huevos de pollo). En el endospermo de las semillas de cereales – centeno, arroz, trigo – moléculas de proteínas se acumulan. Se llaman inclusiones celulares. Estas sustancias se utilizan en el embrión de la semilla en el comienzo de su desarrollo. Además, el alto contenido de proteínas del gorgojo del trigo es un indicador muy importante de la calidad de la harina. Pan horneado de la harina rica en gluten tiene una alta calidad de sabor y más útil. El gluten contiene la llamada de trigo duro. La alta mar plasma sanguíneo de pescado contiene proteínas que impiden su muerte por el frío. Ellos poseen las propiedades anticongelantes, la prevención de la muerte del organismo a bajas temperaturas de agua. Por otro lado, en la composición de la pared celular de las bacterias termófilas en fuentes geotérmicas contenida proteínas capaces de retener su configuración natural (estructura terciaria o cuaternaria) y no se desnaturaliza a temperaturas que van desde 50 a + 90 ° C.
proteido
Estas son proteínas complejas, que se caracterizan por una gran diversidad en relación con las diversas funciones realizadas por ellos. Como se ha señalado anteriormente, el grupo de polipéptidos, a excepción de la porción de proteína contiene un grupo prostético. Bajo la influencia de diversos factores, tales como alta temperatura, sales de metales pesados, se concentró proteínas complejas alcalinos y ácido puede alterar su forma espacial, simplificándolo. Este fenómeno se llama desnaturalización. La estructura de las proteínas complejas es interrumpida enlaces de hidrógeno se rompen, y las moléculas pierden sus propiedades y funciones. Por regla general, la desnaturalización es irreversible. Pero algunos de los polipéptidos actuar como un catalizador, la conducción y las funciones de señalización, es posible renaturalización – la restauración de la estructura natural de los proteidos.

Si la acción es un factor de desestabilización en busca de un largo tiempo, la molécula de proteína se destruye por completo. Esto conduce a la ruptura de los enlaces peptídicos de la estructura primaria. Restaurar la proteína y su función ya no es posible. Este fenómeno se llama destrucción. Un ejemplo es la cocción de los huevos: proteína líquida – albúmina, situada en la estructura terciaria está completamente destruida.
la biosíntesis de proteínas
Una vez más, recordar que en los polipéptidos de organismos vivos consta de 20 aminoácidos, algunos de los cuales son irremplazables. Este lisina, metionina, fenilalanina, y así sucesivamente. D. entran en el torrente sanguíneo desde el intestino delgado después de su división productos proteicos. Para sintetizar aminoácidos esenciales (alanina, prolina, serina), los hongos y los animales usan compuestos que contienen nitrógeno. Plantas, siendo autótrofa, forman independientemente un monómeros constituyentes necesarios representan proteínas complejas. Para este reacciones de asimilación son nitratos usados, amoníaco, o libre de nitrógeno. En algunos tipos de microorganismos proveerse de un conjunto completo de aminoácidos, mientras que en otros sólo algunos están monómeros sintetizados. Etapas de la biosíntesis de proteínas se producen en las células de todos los organismos vivos. En el núcleo de la transcripción se produce, y en el citoplasma de la célula – difusión.
El primer paso – la síntesis del precursor de ARNm se produce por la enzima ARN polimerasa. Él rompe los enlaces de hidrógeno entre las cadenas de ADN, y uno de ellos en el principio de complementariedad recoge molécula de pre-ARNm. Se expone a slaysingu que está maduro, y luego sale del núcleo al citoplasma, formando ácido ribonucleico mensajero.
Para implementar la segunda etapa requiere una específica orgánulos – ribosomas y la información molecular y la transferencia de ácidos ribonucleicos. Otra condición importante es la presencia de ATP, como las reacciones metabolismo de plástico, que pertenece a la biosíntesis de proteínas tiene lugar con la absorción de energía.
Enzimas, su estructura y función
Esto es un gran grupo de proteínas (alrededor de 2000), realizando el papel de las sustancias que afectan a la velocidad de las reacciones bioquímicas en las células. Pueden ser simples (trepsin, la pepsina) o compleja. proteínas complejas que constan de apoenzima y la coenzima. La especificidad de la proteína en relación con los compuestos para los que actúa, determina una coenzima, y se observa actividad de proteidos sólo en el caso en el que el componente de proteína ligada a la apoenzima. La actividad catalítica de la enzima es independiente de la molécula, sino sólo por el centro activo. Su estructura corresponde a la estructura química de las sustancias catalizadas por el principio de "llave-cerradura", por lo que la acción de las enzimas es estrictamente específica. Funciones de las proteínas complejas están en la participación en procesos metabólicos y en su uso como aceptores.
Clases de proteínas complejas
Fueron desarrollados por los bioquímicos, basado en 3 criterios: propiedades físico-químicas, características y rasgos estructurales proteidos especificidad. El primer grupo incluye los polipéptidos de diferentes propiedades electroquímicas. Se dividen en básico, neutro y ácido. En relación con las proteínas de agua puede ser hidrófilo, anfífilo y hidrófoba. El segundo grupo de enzimas que se han considerado previamente. El tercer grupo incluye polipéptidos que difieren en la composición química grupo prostético (es chromoproteids, nucleoproteínas, metaloproteínas).
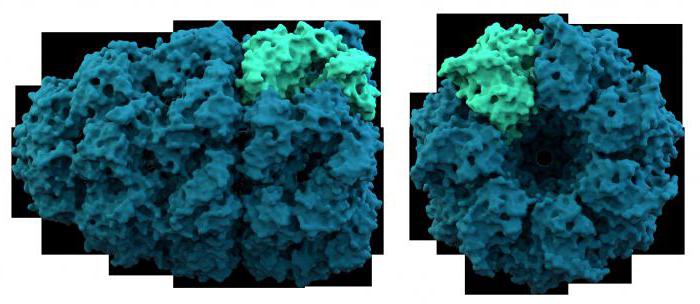
Tenga en cuenta las propiedades de las proteínas complejas con más detalle. Así, por ejemplo, proteína ácida que es parte de los ribosomas, contiene 120 aminoácidos y es versátil. Se encuentra en los orgánulos de proteína-sintetizar, tanto en células procariotas y eucariotas. Otro miembro de este grupo – proteína S-100, consiste en dos cadenas con enlaces de iones de calcio. Él es un miembro de las neuronas y glía – tejido de sostén del sistema nervioso. La propiedad común de todos proteína ácida – un alto contenido de ácidos dicarboxílicos: glutámico y aspártico. Por proteínas alcalinos incluyen histonas – proteínas que componen los ácidos nucleicos de ARN y ADN. La peculiaridad de la composición química es la gran cantidad de lisina y arginina. Las histonas, junto con la forma de cromosomas cromatina nuclear – crítico estructura celular herencia. Estas proteínas están implicadas en los procesos de transcripción y traducción. proteínas anfifílicas ampliamente representadas en las membranas celulares, formando una bicapa de lipoproteínas. Así, el grupo estudió las proteínas complejas anteriormente discutidos, estábamos convencidos de que sus propiedades físico-químicas debido a la estructura del componente de proteína y grupos prostéticos.
Algunas proteínas de membrana celular complejos son capaces de reconocer una variedad de compuestos químicos, tales como antígenos y reaccionar a ellos. Esta señalización proteidos de función, es muy importante para los procesos de absorción selectiva, las sustancias desde el entorno externo, y para protegerlo.
Glicoproteínas y proteoglicanos
Ellos son proteínas complejas que difieren entre una composición bioquímica grupos prostéticos. Si los enlaces químicos entre el componente de proteína y la parte de hidratos de carbono – covalentemente-glucósido, tales sustancias se denominan glicoproteínas. Apoenzima que presenta moléculas de mono- y oligosacáridos, los ejemplos de tales proteínas son de protrombina, fibrinógeno (proteínas implicadas en la coagulación de la sangre). Kortiko- y gonadotropicas hormonas, interferones, enzimas y membranas son glicoproteínas. En las moléculas parte proteica de proteoglicanos es sólo el 5%, siendo el resto un grupo prostético (geteropolitsaharid). Ambas partes están conectadas por un enlace glicosídico de los grupos del grupo-treonina y arginina OH y NH $ ₂ $-glutamina, y lisina. moléculas de proteoglicanos juegan un papel muy importante en las células de metabolismo agua-sal. A continuación se muestra una tabla de proteínas complejas, hemos estudiado.
| glicoproteínas | proteoglicanos |
| Los componentes estructurales de grupos prostéticos | |
| 1. monosacáridos (glucosa, galactosa, manosa) | 1. Ácido Hialurónico |
| 2. oligosacáridos (maltosa, lactosa, sacarosa) | 2. ácido condroitina. |
| 3. Los derivados de aminoácidos acetilados de monosacáridos | 3. La heparina |
| 4. Dezoksisaharidy | |
| 5. ácido neuramínico y siálico | |
metaloproteınas
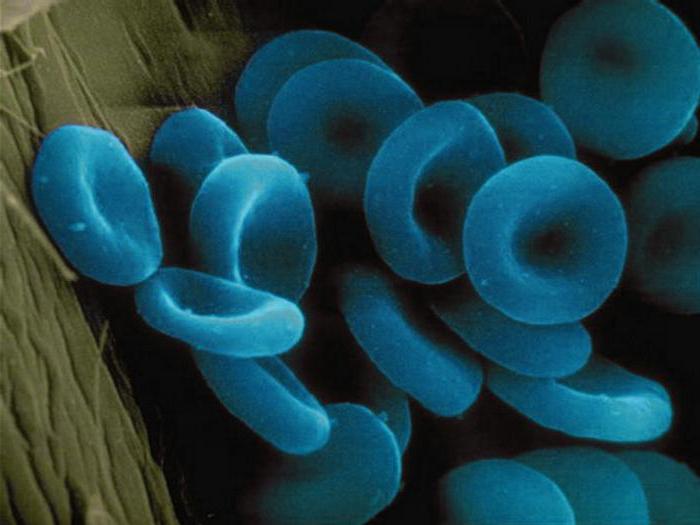
Estos materiales contienen como parte de su ion molecular de uno o más metales. Considere ejemplos de proteínas complejas que pertenecen al grupo anteriormente. Es por encima de todas las enzimas tales como la citocromo oxidasa. Está situado en las crestas de las mitocondrias y activa la síntesis de ATP. Ferrin y transferrina – proteídea que contiene iones de hierro. depósitos Origen ellos en las células, y la segunda es el transporte de proteína de la sangre. Otro metaloproteínas – alfaamelaza que contiene iones de calcio está incluido en el composición de la saliva y el jugo pancreático, que participan en la división de almidón. La hemoglobina es como metaloproteínas y hromoproteidov. Él sirve como una proteína de transporte que transporta el oxígeno. El resultado es un compuesto de la oxihemoglobina. La inhalación de monóxido de carbono, o monóxido de llamada de carbono, sus moléculas de hemoglobina formar eritrocitos compuesto muy estables. Rápidamente se extiende a los órganos y tejidos, causando la intoxicación celular. Como resultado, la inhalación después de prolongada de la muerte de monóxido de carbono se produce por asfixia. La hemoglobina parcialmente lleva y dióxido de carbono formado en los procesos catabólicos. A partir de la corriente de la sangre de dióxido de carbono a los pulmones y riñón, y de ellos – con el medio ambiente externo. Algunos proteína transportadora de crustáceos y moluscos que transporta el oxígeno, es el ojo de la cerradura. En lugar de la plancha que contiene iones de cobre, por lo que la sangre de animales no es rojo, y azul.
función clorofílica
Como hemos mencionado anteriormente, las proteínas complejas pueden formar complejos con pigmentos – sustancias orgánicas coloreadas. Su color depende de los grupos hromoformnyh que absorben selectivamente ciertos espectros de la luz solar. En las células vegetales tiene plástidos verdes – cloroplastos que contienen pigmento clorofila. Se compone de átomos de magnesio y un alcohol polihídrico, fitol. Están asociados con moléculas de proteína, y de ellos mismos contienen cloroplastos tilacoides (placas), o asociadas a la membrana en pilas – faceta. Son pigmentos fotosintéticos – clorofila – y carotenoides adicionales. Aquí están todas las enzimas utilizadas en las reacciones fotosintéticas. Por lo tanto chromoproteids, que incluyen clorofila, realizan funciones críticas en el metabolismo, es decir, en las reacciones de la asimilación y disimilación.
proteínas virales
Ellos incluyen representantes de las formas no celulares de vida, entrando en el reino de Vir. Los virus no tienen su propio aparato de proteínas que sintetizan. Los ácidos nucleicos, ADN o ARN, pueden inducir la síntesis de la mayoría de las partículas propias células infectadas con virus. virus simples consisten solamente de moléculas de proteína, de forma compacta ensamblados en una estructura helicoidal o una forma poliédrica, como el virus del mosaico del tabaco. virus complejos tienen membrana adicional que forma parte de la membrana plasmática de la célula huésped. Como se puede incluir glicoproteínas (virus de la hepatitis B, virus de la viruela). La función principal de las glicoproteínas – un reconocimiento de receptores específicos en la membrana de la célula huésped. La composición de las membranas y proteínas virales adicionales incluyen enzimas que proporcionan reduplicación de ADN o transcripción de ARN. Basándose en lo anterior, se puede concluir lo siguiente: virales proteínas de partículas cáscaras tienen una estructura específica, en función de las proteínas de la membrana de la célula huésped.
En este artículo se nos ha dado las características de las proteínas complejas, estudiado su estructura y función en células de diversos organismos.















