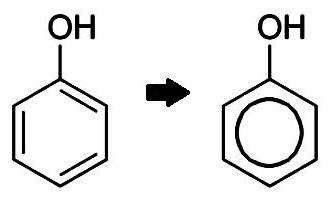
fórmula molecular y estructural de fenol
Fenoles – el nombre común de los alcoholes aromáticos. En las propiedades de la materia son ácidos débiles. Un significado práctico importante son muchos homólogos C hidroxibenceno 6 H 5 0H (fórmula fenol) – representante más simple de la clase. Veamos esto con más detalle.
Fenoles. La fórmula general y clasificación
La fórmula general de las sustancias orgánicas de alcoholes aromáticos, – R-OH. Propia molécula fenoles y cresoles radical formado – C6H5 fenilo, que está conectado directamente a uno o más grupos hidroxilo OH (grupos hidroxilo). Por su número por fenoles moléculas se clasifican en mono-, di- y polivalente. compuestos monohídricos de este tipo son fenol y cresol. El más común entre hidroxibencenos polihídricos – naftoles que contienen en su núcleo fusionado composición 2.
Fenol – el representante de alcoholes aromáticos
Los trabajadores textiles fenol era conocido ya en el siglo XVIII: los tejedores utilizan como un medio de contraste. En la destilación de alquitrán de hulla en 1834 en Alemania, el químico F. Runge destacó cristales de la sustancia con un olor dulce característico. El nombre latino carbón – carbo, llamado compuesto ácido carbólico (ácido carbólico). Investigadores alemanes han logrado identificar la sustancia. fórmula Fenol Molecular se estableció en 1842 O. Laurent, que creía derivado carbólico de benceno. Para el nuevo ácido usado el nombre de "fenilo". Sharl Zherar determinó que la sustancia es alcohol, y lo llamó un fenol. Las aplicaciones iniciales compuestos – medicina, curtido de pieles, producción de colorantes sintéticos. Características de la sustancia considerada:
- Rational fórmula química – C 6 H 5 OH.
- El peso molecular del compuesto – y 94,11. e. m.
- La fórmula bruta del agregado, – C 6 H 6 O.

Estructura electrónica y espacial de una molécula de fenol
estructura cíclica de fórmula benceno ofrecido por alemán químico orgánico F. Kekulé en 1865, y poco antes de que – I. Loschmidt. Los científicos tienen una molécula de la materia orgánica en la forma de un hexágono regular con la alternancia de enlaces simples y dobles. De acuerdo con los conceptos modernos, el anillo aromático – un tipo especial de estructura circular, llamado "enlace conjugado".
Seis átomos de carbono prueban proceso sp 2 -hybridization orbitales de electrones. No involucrado en la formación de enlaces C-C de las nubes p-electrón superponerse encima y por debajo del plano del núcleo de la molécula. Hay dos nube de electrones común que cubre todo el anillo. Fenol fórmula estructural puede ser diferente, dado el enfoque histórico de la descripción de la estructura del benceno. Con el fin de enfatizar el carácter de hidrocarburos aromáticos insaturados, convencionalmente considerado tres de los seis dobles enlaces que alternan con tres simple.
La polarización debido a grupo oxi
En el más simple de hidrocarburo aromático – benceno, C 6 H 6 – nube de electrones es simétrica. fórmula fenol difiere por un grupo hidroxi. La presencia de hidroxilo rompe la simetría que se refleja en las propiedades de la sustancia. La relación entre el oxígeno y el hidrógeno en un grupo hidroxi – covalente polar. Offset par común de electrones al átomo de oxígeno conduce a una misma carga negativa (parcial). El hidrógeno pierde electrones y adquiere una carga parcial "+". Además, el oxígeno del grupo O-H es el propietario de dos pares de electrones no compartidos. Uno de ellos atraídos por la nube de electrones del anillo aromático. Por esta razón, la comunicación se vuelve más polarizadas, hidrógeno fácilmente reemplazado metales. Los modelos dan una idea de la naturaleza asimétrica de la molécula de fenol.
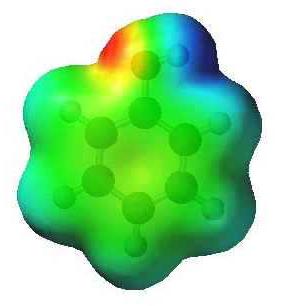
Características átomos de interferencia en fenol
Una nube de electrones de los núcleos aromáticos en la molécula de fenol reacciona con un grupo hidroxilo. Se produce fenómeno, nombre de la conjugación, en el que un propio par átomo de oxígeno de electrones atrajo a los grupos hidroxi de un sistema de anillo de benceno. La reducción de la carga negativa compensado por una mayor polarización debido al grupo O-H.
El anillo aromático también varía sistema de distribución electrónica. Se reduce por el carbono que está unido a oxígeno, y se incrementa a más cercano a la misma átomos en las posiciones orto (2 y 6). El emparejamiento es la acumulación de carga en ellos "-". Además "densidad de desplazamiento – su movimiento de los átomos en los meta-posiciones (3 y 5) al carbono en la posición para (4). fenol fórmula estudio por conveniencia y acoplamiento mutuo comprende usualmente numeración de los átomos del anillo de benceno.
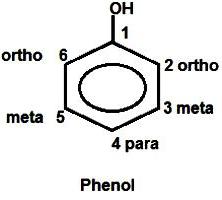
propiedades químicas Explicación de fenol en función de su estructura electrónica
Procesos de conjugación del anillo aromático e hidroxilo afecta a las propiedades de ambas partículas y todas las sustancias. Por ejemplo, una alta densidad de electrones en el átomo en las posiciones orto y (2, 4, 6) hace que el enlace C-H de un ciclo de fenol aromático más reactivo. carga negativa reducida de los átomos de carbono en posiciones meta (3 y 5). Ataque de partículas electrófilos en las reacciones químicas expuestas de carbono en la posiciones orto y para. La reacción de bromación de los cambios de benceno se produce con calentamiento fuerte y la presencia de un catalizador. monogalogenoproizvodnoe formada – bromobenceno. Fórmula fenol permite sustancia a reaccionar con bromo sustancialmente instantánea sin calentamiento de la mezcla.
Anillo aromático afecta el grupo hidroxi conexión de polaridad, aumentarla. El hidrógeno se hace más flexible, en comparación con alcoholes saturados. El fenol reacciona con álcalis, formando sales – fenatos. El etanol no reacciona con álcali, o más bien, los productos de reacción – etanolatos – descomponga. En términos fenoles químicos – ácido más fuerte que alcoholes.
Representantes de clase alcoholes aromáticos
Molecular fenol fórmula homólogo – cresol (metilfenol hidroxitolueno) – C 7 H 8 O. Sustancia en materias primas naturales a menudo acompaña fenol, también tiene propiedades antisépticas. Otros homólogos de fenol:
- Catecol (1,2-hidroxibenceno). Fórmula química – C 6 H 4 (OH) 2.
- Resorcinol (1,3-hidroxibenceno) – C 6 H 4 (OH) 2.
- Pirogalol (1,2,3-trihidroxibenceno) – C 6 H 3 (OH) 3.
- Naftol. Sustancia fórmula Molecular – C 10 H 7 OH. Se utiliza en la fabricación de colorantes, medicamentos, compuestos aromáticos.
- Timol (2-isopropil-5-metilfenol). Fórmula química – C 6 H 3 CH 3 (OH) (C 3 H 7). Se utiliza en química orgánica sintética, y la medicina.
- La vainillina excepto radical fenólico contiene un grupo éter y un residuo de aldehído. Molecular compuesto fórmula – C 8 H 8 O 3. La vainillina se utiliza ampliamente como un saborizante artificial.
reactivo de Fórmula para la detección de fenoles
Determinación cualitativa de fenol puede llevarse a cabo usando bromo. Como resultado de la reacción de sustitución de un precipitado tribromofenol blanco. Catecol (1,2-hidroxibenceno) está coloreado en color verde en presencia de cloruro férrico disuelto. Con el mismo reactivo reacciona con fenol y se forma un trifenol que tiene un color violeta. reacción cualitativa de resorcinol – apariencia de color de violeta oscuro en presencia de cloruro férrico. Poco a poco, el color de la solución se vuelve negro. La fórmula del reactivo, que se utiliza para reconocer cierto fenol y sus homólogos, – FeCl 3 (cloruro férrico (III)).
Hidroxibenceno, naftol, timol – todos los fenoles. La fórmula general de la sustancia a determinar la composición de estos compuestos a la serie aromática. Todos los compuestos orgánicos que contienen en su fórmula radical fenilo C 6 H 5, con el que los grupos hidroxi están directamente vinculadas a exhibir propiedades especiales. Se diferencian de alcohol se expresa mejor la naturaleza ácida. En comparación con sustancias homóloga serie de benceno, fenoles – compuesto químico más activo.