A nuestro alrededor el mundo se compone de pequeños, imperceptibles para el ojo de las partículas. Los electrones – este es uno de ellos. Su descubrimiento ha tenido lugar hace relativamente poco tiempo. Y se abrió una nueva comprensión de la estructura del átomo, los mecanismos de transmisión de energía eléctrica y la estructura del mundo en su conjunto.
Cómo dividir lo indivisible
La moderna comprensión de electrones – este partículas elementales. Ellos son consistentes y no se dividen en estructuras más pequeñas. Pero esta idea no ha existido siempre. Hasta 1897 sobre los electrones no tenían ni idea.
Más pensadores antigua Grecia supuso que cada elemento de la luz, el edificio consta de una pluralidad de "ladrillos" microscópicas. La unidad más pequeña de materia consideró entonces el átomo, y esta creencia persistió durante siglos.
Representación del átomo lo ha cambiado sólo a finales del siglo XIX. Después de investigaciones J. Thomson, E. Rutherford, H. Lorenz, P. Zeeman han sido reconocidos partículas más pequeñas indivisibles núcleos atómicos y electrones. Con el tiempo, se descubrió protones, neutrones, e incluso más tarde – el neutrinos, kaones, piones, etc …
Ahora la ciencia conoce un gran número de partículas elementales, el lugar del que invariablemente ocupado y electrones.

El descubrimiento de una nueva partícula
En el momento en que eran electrones descubiertos en el átomo, los científicos saben desde hace tiempo de la existencia de la electricidad y el magnetismo. Pero la verdadera naturaleza y las propiedades completas de estos fenómenos son todavía un misterio, que ocupa las mentes de muchos físicos.
A principios del siglo XIX se sabía que la propagación de la radiación electromagnética, la velocidad de la luz. Sin embargo, el inglés Dzhozef Tomson, la realización de experimentos con rayos catódicos, llegó a la conclusión de que consisten de muchos pequeños granos cuya masa es inferior a nuclear.

En abril de 1897, Thompson hizo una presentación en la que presentó a la comunidad científica el nacimiento de una nueva partícula en la composición de los átomos, que llamó corpúsculos. Más tarde, Ernest Rutherford usando experimentos de papel de aluminio confirmó las conclusiones de su maestro, y los corpúsculos se le dio otro nombre – "electrones".
Este descubrimiento llevó al desarrollo de la ciencia no sólo física, sino también química. Es posible realizar progresos significativos en el estudio de la electricidad y el magnetismo, propiedades de la materia, y dio lugar a la física nuclear.
¿Qué es un electrón?
Los electrones – es las partículas más ligeras con una carga eléctrica. Nuestro conocimiento de ellos aún permanecen en gran medida contradictoria e incompleta. Por ejemplo, en las ideas modernas que viven para siempre, porque nunca se romperá, a diferencia de los neutrones y los protones (colapso teórico de la última edad supera la edad del universo).
Los electrones son estables y tienen una carga negativa constante e = 1,6 x 10 -19 Cl. Pertenecen a la familia de fermiones y leptones grupo. Las partículas que participan en una interacción electromagnética y gravitacional débil. Se componen de átomos. Las partículas que han perdido el contacto con los átomos – los electrones libres.
La masa de los electrones es de 9,1 x 10 -31 kg y es 1836 veces menor que la masa de un protón. Tienen media integral y efectos y un momento magnético. Electrones denotado por la letra "e -". Lo mismo, pero con un signo más indica su antagonista – positrones antipartícula.
Estado de los electrones en un átomo
Cuando se hizo evidente que un átomo se compone de estructuras más pequeñas, era necesario entender exactamente cómo se organizan en ella. Así que al final del siglo XIX apareció el primer modelo del átomo. De acuerdo con el modelo planetario, protones (carga positiva) y neutrones (neutros) constituían el núcleo. A los electrones moviéndose en órbitas elípticas.
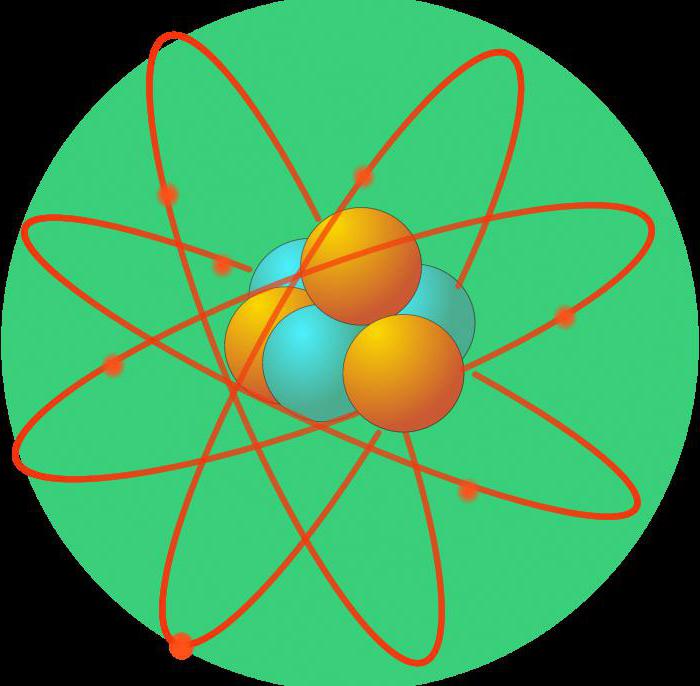
Estas percepciones están cambiando con el advenimiento de la física cuántica en el siglo XX. Lui De Broglie planteó la teoría de que el electrón se comporta no sólo como una partícula, pero también como una onda. Erwin Schrodinger crea un modelo de onda del átomo, donde los electrones están representadas por una nube con cierta densidad de carga.

Para determinar la ubicación y la trayectoria de los electrones alrededor del núcleo es prácticamente imposible. En este sentido, introducido un término especial "orbital" o "nube de electrones", que es el espacio de los lugares más probables de dichas partículas.
los niveles de energía
La nube de electrones alrededor de un átomo apenas tanto y protones en su núcleo. Todos ellos están a diferentes distancias. Más cercano al núcleo están electrones con la menor cantidad de energía dispuestos. El más energía es en las partículas, más que sean.
Pero ellos no están dispuestas al azar, y toman niveles específicos, que pueden acomodar sólo un determinado número de partículas. Cada nivel tiene su propia cantidad de energía y se divide en sub-niveles, y éstos, a su vez, en los orbitales.
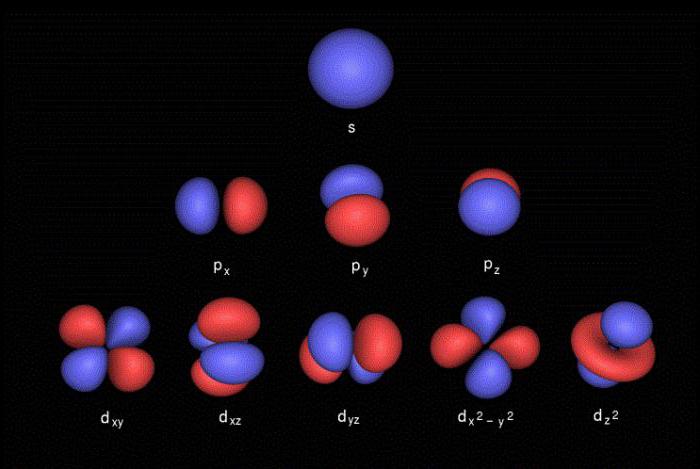
Para describir las características y ubicación de los electrones en los niveles de energía, cuatro números cuánticos :
- n – la reserva de energía de electrones número entero principal especificando (corresponde al número del período elemento químico);
- l – Número orbital, que describe la forma de la nube de electrones (s – esférica, p – forma de ocho, d – la forma de trébol o ochos dobles, f – una forma geométrica compleja);
- m – número de orientación nube definir magnético en un campo magnético;
- MS – el número de giro, lo que caracteriza a la órbita de los electrones alrededor de su eje.
conclusión
Por lo tanto, los electrones – una estable, las partículas cargadas negativamente. Ellos son básicas y no pueden decaer en otros elementos. Se hace referencia a partículas tan fundamentales, es decir, los que son parte de la estructura de la materia.
Los electrones se mueven alrededor de los núcleos y forman su capa de electrones. Afectan a las propiedades químicas, ópticas, mecánicas y magnéticas de varias sustancias. Estas partículas están involucrados en la interacción electromagnética y gravitacional. Su movimiento direccional crea un campo de corriente eléctrica y magnética.