Características de azufre. Aplicación de azufre. azufre médica
Calcógenos – elementos del grupo se refiere a un azufre. Su símbolo químico – S – la primera letra del nombre latino de azufre. Composición sustancia simple registrada por este símbolo sin índice. Tenga en cuenta los puntos principales con respecto a la estructura, propiedades, preparación y uso de este elemento. características de azufre se presentarán en detalle como sea posible.
características comunes y las diferencias chalcogen
El azufre se refiere a un subgrupo de oxígeno. Este es el equipo 16 en el período de tiempo más modernas forman la imagen del sistema periódico (PS). habitaciones anticuadas e índice – VIA. Los nombres de los elementos químicos del grupo, los símbolos químicos:
- oxígeno (O);
- azufre (S);
- selenio (Se);
- telurio (Te);
- polonio (Po).
Los elementos de la cáscara de electrones exteriores dispuestos por encima del mismo. Contiene todos los seis electrones de valencia que pueden participar en la formación de enlaces químicos con otros átomos. compuestos de hidrógeno tienen la estructura H 2 R, por ejemplo, H 2 S – sulfuro de hidrógeno. Nombres de elementos químicos que forman con el oxígeno dos tipos de compuestos: azufre, selenio y teluro. fórmulas generales óxidos de estos elementos – RO 2, RO 3.
Calcógeno corresponden a sustancias simples, que difieren en gran medida en svostvam física. El más común en la corteza de todos los chalcogen – oxígeno y azufre. El primer elemento define dos gas, el segundo – los sólidos. El polonio – el elemento radiactivo – raro en la corteza terrestre. En el grupo de oxígeno a propiedades metálicas polonio disminución y aumento de metal. Por ejemplo, el azufre – típica no metal y el teluro tiene un brillo metálico y conductividad eléctrica.

№ elemento 16 de la DI sistema periódico Mendeleev
El pariente azufre peso atómico – 32.064. Del isótopo natural más común 32 S (más de 95% en peso). Se encuentra en pequeñas cantidades con núclidos masa atómica de 33, 34 y 36. La característica de azufre sobre la situación en el SS y la estructura atómica:
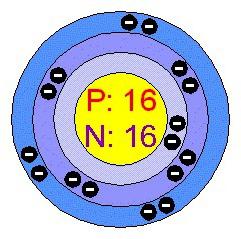
- número de serie – 16;
- carga del átomo es 16;
- radio atómico – 0.104 nm;
- energía de ionización de -10,36 eV;
- relativa electronegatividad – 2,6;
- el grado de oxidación en compuestos – 6, 4, 2, -2;
- valencia – II de (-), II (+), IV (+), VI (+).
El azufre es en el tercer período; electrones en un átomo se encuentran en tres niveles de energía: la primera – 2, el segundo – 8, – la tercera 6. electrones de valencia son todos externos. Al interactuar con los elementos de azufre más electronegativo da 4 o 6 electrones, la adquisición de estado de oxidación típico 6, 4. Las reacciones con hidrógeno y un átomo de metal atrae electrones que faltan dos octetos para llenar y para lograr el estado de equilibrio. La oxidación en este caso se reduce a -2.
Las propiedades físicas del rómbico y formas alotrópicas monoclínica
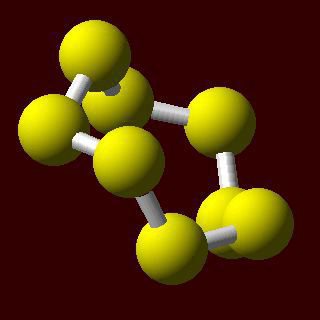
En condiciones normales, los átomos de azufre se unen entre sí en un ángulo en el circuito estable. Ellos pueden ser cerradas en un anillo, lo que sugiere la existencia de moléculas de azufre cíclicos. Composición de Fórmula reflejan S 6 y S 8.
características de azufre deben complementarse Descripción de las diferencias entre las modificaciones alotrópicas que tienen diferentes propiedades físicas.
Rómbico o α-azufre – la forma cristalina más estable. Este luminoso cristales de color amarillo, que consiste en moléculas de S 8. densidad de azufre rómbico es 2,07 g / cm3. cristales amarillo claro de la forma monoclínica de azufre β-formado a una densidad de 1,96 g / cm3. Punto de ebullición llega a 444,5 ° C.
Preparación de azufre amorfo
¿De qué color es el azufre en estado plástico? Esta es una masa de color marrón oscuro, bastante similar al polvo de color amarillo o cristales. Para obtenerlo, es necesario para fundir el azufre rómbico o monoclínico. En está formado temperaturas por encima de 110 ° C un líquido, mientras se calienta más que oscurece a 200 ° C se vuelve espesa y viscosa. Si se vierte rápidamente el azufre fundido en agua fría, se endurece para formar cadenas en zig-zag, que estructura refleja la fórmula S n.

La solubilidad del azufre
Algunas modificaciones de una sustancia soluble en disulfuro de carbono, benceno, tolueno o amoníaco líquido. Si se enfría lentamente soluciones orgánicas se forman entonces las agujas de azufre monoclínico. Por evaporación de los líquidos de pie cristales de color amarillo limón claras del azufre rómbico. Son frágiles, se pueden moler fácilmente hasta obtener un polvo. El azufre es insoluble en agua. Los cristales se hunden hasta el fondo del recipiente, y el polvo pueden flotar en la superficie (no humectable).
propiedades químicas
Las reacciones se muestran las propiedades típicas elemento no metálico № 16:
- de azufre se oxida metales y de hidrógeno, se reduce a S 2- iónico;
- la combustión del aire y oxígeno se producen di- y trióxido de azufre, que son anhídridos de ácido;
- por reacción con otro elemento más electronegativo – fluoro – azufre también pierde sus electrones (oxidan).
azufre libre en la naturaleza
Como la prevalencia de azufre en la corteza terrestre está en el lugar 15 entre los elementos químicos. El contenido medio de átomos de S en rocas y minerales es de 0,05% en peso de la corteza.
¿De qué color es el azufre en la naturaleza (nativo)? Este polvo de color amarillo claro con un olor característico o cristales de color amarillo que tienen un brillo de vidrio. Los depósitos en forma de depósitos, las capas cristalinas de azufre encuentran en zonas de actividad volcánica antigua y moderna en Italia, Polonia, Oriente Medio, Japón, México, Estados Unidos. A menudo, la extracción de drusas es un bonito y gigantes cristales individuales.
El sulfuro de hidrógeno y los óxidos en la naturaleza
En las regiones volcánicas se encuentran en la superficie del compuesto de azufre gaseoso. Mar Negro a una profundidad de más de 200 m es sin vida debido a la separación de sulfuro de hidrógeno H 2 S. La fórmula de óxido de azufre divalente – SO 2, trivalente – SO 3. Estos compuestos gaseosos están presentes en la composición de algunos de los de petróleo, gas, aguas naturales. El azufre se incluye en la composición de carbón. Es necesario para la construcción de muchos compuestos orgánicos. Cuando putrefacción de las proteínas de los huevos de gallina en libertad sulfuro de hidrógeno, por lo que se dice a menudo que el olor del gas de huevos podridos. El azufre es de los elementos biogénicos, es necesario para el crecimiento y desarrollo del hombre, los animales y las plantas.

Importancia de los sulfuros y sulfatos naturales
Características de azufre será incompleta si no quiere decir que el elemento se encuentra no sólo en la forma de una sustancia simple y óxido. Los compuestos naturales más comunes – es una sal de ácido sulfúrico y sulfuro de hidrógeno. Los sulfuros de cobre, hierro, zinc, mercurio, plomo que se encuentra en la composición de los minerales calcopirita, pirita, esfalerita, galena, y cinabrio. De sulfatos se pueden mencionar sales de sodio, calcio, bario y magnesio que se forman en los minerales de la naturaleza y rocas (mirabilite, yeso, selenito, barita, kieserita, epsomita). Todos estos compuestos se utilizan en diversos sectores de la economía, se utilizan como materias primas para procesamiento industrial, fertilizantes, materiales de construcción. Gran valor médica de ciertos cristalina.
recepción
sustancia amarilla en el estado libre se produce en la naturaleza a diferentes profundidades. Si es necesario, el azufre se funde a partir de rocas sin elevar a la superficie, mientras que el bombeo de la profundidad sobrecalentado vapor y aire comprimido. Otro método implica la sublimación de rocas trituradas en hornos especiales. Otros métodos implican la disolución de disulfuro de carbono o flotación.
requisitos de la industria de azufre grande, por lo que obtienen su sustancia elemental compuesto utilizado. El sulfuro de hidrógeno y sulfuro de azufre está en la forma reducida. El estado de oxidación del elemento es igual a -2. oxidación del azufre se lleva a cabo mediante el aumento del valor a 0. Por ejemplo, el método de sulfato de sodio LeBlanc se reduce a sulfuro de carbono. A continuación, se obtiene a partir de sulfuro de calcio, se trata con dióxido de carbono y vapor de agua. El sulfuro de hidrógeno resultante se oxida por el oxígeno atmosférico en presencia de un catalizador: 2H 2 S + O 2 = 2H 2 O + 2S. Determinación de azufre obtenida de diferentes maneras, a veces da indicadores de baja pureza. Refinación o la purificación se lleva a cabo por destilación, rectificación, mezclas de procesamiento de ácidos.

El uso de azufre en la industria moderna
azufre granular va a diferentes necesidades de producción:
- Preparación de ácido sulfúrico en la industria química.
- sulfitos y sulfatos de producción.
- Soltar preparaciones para la fertilización de las plantas, enfermedades y plagas.
- minerales en plantas mineras y químicas procesadas para metales no ferrosos que contienen azufre. producción concomitante es ácido sulfúrico.
- La introducción de algunos tipos de acero para impartir propiedades especiales.
- vulcanización del caucho Debido obtuvo caucho.
- Producción de los partidos, pirotecnia, explosivos.
- Uso para la preparación de pinturas, pigmentos, fibras sintéticas.
- blanqueo de tejidos.
Toxicidad de azufre y sus compuestos
partículas de polvos que tienen un olor desagradable, irritar las membranas mucosas de la cavidad nasal y el tracto respiratorio, los ojos y la piel. Sin embargo, la toxicidad de azufre elemental no se considera particularmente alto. La inhalación de sulfuro de hidrógeno y dióxido de puede causar intoxicación grave.
Si asar mineral que contiene azufre en fundiciones de gases de escape no son atrapados, entran en la atmósfera. Conexión con gotas y de vapor de agua, óxidos de azufre y nitrógeno dan lugar a la llamada lluvia ácida.
El azufre y sus compuestos en la agricultura
Plantas consumen iones sulfato junto con la solución del suelo. La reducción del contenido de azufre conduce a una ralentización en el metabolismo de las células verdes de aminoácidos y proteínas. Por lo tanto sulfatos utilizado para la fertilización de cultivos agrícolas.

Para desinfectar los gallineros, bodegas, tiendas de verduras sustancia simple quemado o tratado con instalaciones modernas sulfamidas. óxido de azufre posee propiedades antimicrobianas que han encontrado largo aplicación en la producción de vino cuando se almacena verduras y frutas. drogas de azufre se utilizan como plaguicidas para el control de enfermedades y plagas (mildiu pulverulento y ácaros araña).
Utilizado en la medicina

Gran importancia para el estudio de las propiedades medicinales de polvo amarillo dio grandes médicos de la antigüedad Avicena y Paracelso. Más tarde se determinó que la persona no está recibiendo suficiente de azufre de los alimentos se debilita, experimentando problemas de salud (que incluyen picor y descamación de la piel, el cabello y las uñas debilitamiento). El hecho es que sin azufre síntesis de aminoácidos, queratina, procesos bioquímicos en el cuerpo afectada.
azufre médico incorporado en el ungüento para el tratamiento de enfermedades de la piel: acné, eczema, psoriasis, alergia, seborrea. Baños con azufre pueden aliviar el dolor de reumatismo y gota. Para una mejor absorción por el cuerpo para crear las sulfonamidas solubles en agua. Esto no es un polvo de color amarillo, una sustancia blanca cristalina fina. Para aplicaciones al aire libre se administra este compuesto en la cosmética para el cuidado de la piel.
El yeso se ha utilizado en la inmovilización de las partes dañadas del cuerpo. sal de Glauber se prescribe como un medicamento laxante. Magnesia reduce la presión sanguínea que se utiliza en el tratamiento de la hipertensión.
El azufre en la historia
Ya en la antigüedad sustancia no metálica flores amarillas atraen la atención de una persona. Pero sólo en 1789, la gran químico Lavoisier encontró que el polvo y los cristales encuentran en la naturaleza, compuesto de átomos de azufre. Se creía que el mal olor que se produce durante su combustión, repele todo mal. óxido de Fórmula azufre, que se obtiene por la combustión, – SO 2 (sílice). Este inhalación de gases tóxicos que es peligroso para la salud. Varios casos de extinción masiva de poblaciones enteras de personas en las costas, en las tierras bajas de científicos explican la asignación de tierras o hidrógeno agua sulfuro o dióxido de azufre.
La invención de la pólvora aumentó el interés en los cristales de color amarillo por los militares. Muchas batallas fueron ganadas debido a la capacidad de los maestros para combinar con otras sustancias de azufre en la fabricación de explosivos. El compuesto más importante – el ácido sulfúrico – También aprendió a usar un tiempo muy largo. En la Edad Media, es una sustancia que se llama aceite de vitriolo y sal – sulfato. El sulfato de cobre es CuSO4 y sulfato de hierro FeSO4 todavía no se ha perdido su importancia en la industria y la agricultura.