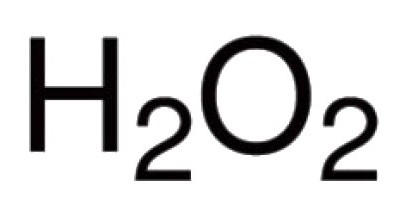¿Cuál es la valencia de oxígeno en los compuestos?
Con el fin de determinar los posibles valores de la valencia de oxígeno, es necesario estudiar la posición del elemento en la tabla periódica, las principales características de la estructura de su átomo. Este enfoque es conveniente al estudiar la cuestión de qué valencia de oxígeno es típica, y que no es característico para ella. En los compuestos más comunes, la valencia habitual es II. Esta característica hace posible determinar el número de enlaces de otro átomo en las fórmulas binarias acabadas con la participación de oxígeno.
¿Qué es la valencia de oxígeno?
En la etapa inicial de acumulación de conocimiento sobre las propiedades y la estructura de las sustancias, los químicos pensaban que la valencia es la capacidad de unir cierto número de átomos a una molécula de materia. Muchos científicos después del descubrimiento del elemento trataron de entender cuál es la valencia del oxígeno. La respuesta se obtuvo experimentalmente: el oxígeno añade dos átomos de hidrógeno monovalente a la reacción química, lo que significa que es bivalente. Las representaciones del enlace químico cambiaron al conocerse la estructura de la materia acumulada. En su teoría de la valencia, G. Lewis y V. Kossel revelan la esencia de la interacción química desde el punto de vista de la estructura electrónica. Los investigadores explicaron la capacidad de un átomo para formar un cierto número de enlaces esforzándose por el estado de energía más estable. Si se logra, la partícula más pequeña de la sustancia se vuelve más estable. En la teoría y las estructuras de Lewis se presta mucha atención al papel de los electrones externos que participan en la creación de un enlace químico.
Características de la colocación de oxígeno en la tabla periódica
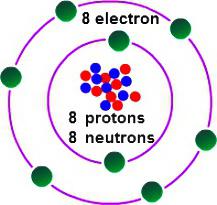
Con el fin de determinar cuál es la valencia de oxígeno, es necesario considerar algunas características de su estructura electrónica. El oxígeno lidera el 16º grupo de la tabla periódica. El nombre trivial de la familia de elementos es "chalcogenes", según una clasificación anticuada pertenecen al grupo VI (A). En la tabla periódica el oxígeno está en la celda debajo del No. 8. El núcleo contiene 8 partículas elementales positivas y neutras. En el espacio de un átomo, hay dos niveles de energía que surgen cuando 8 electrones se mueven, de los cuales 6 son externos.

¿Cuál es la relación entre la composición del átomo y la valencia?
El último nivel del átomo de oxígeno contiene 2 electrones no emparejados. El elemento es inferior al flúor en términos de electronegatividad (la capacidad de atraer pares de electrones vinculantes a sí mismo). En la formación de compuestos con otros elementos, el oxígeno atrae a sí mismo la densidad electrónica total que ha surgido en la molécula (excepto para los electrones de flúor). Alcanzar el estado estable de la envoltura exterior es posible con la adición de dos cargas negativas. Esto significa que el oxígeno requiere 2 electrones. Las opciones posibles son las siguientes: tomar un electrón (valencia II), seleccionar 2 electrones de otro átomo (valencia II), no tomar electrones de otros átomos (valencia 0). El comportamiento típico del oxígeno se caracteriza por el segundo caso. De esta manera se puede utilizar para averiguar qué valencia de oxígeno es más típico en sus compuestos comunes. Estos incluyen la mayoría de los óxidos de metales y no metales.
¿Cómo aparece la valencia en los compuestos?
El oxígeno es capaz de interactuar directamente con muchos elementos químicos. Se conocen sus compuestos con virtualmente todos los representantes de la tabla periódica (con la excepción de los gases inertes: argón, helio, neón). En reacción con halógenos, los metales nobles, el oxígeno no puede entrar directamente, pero existen óxidos de Au2O3, F2O, Cl2O7 y otros (obtenidos indirectamente). Para los compuestos binarios en la formación de los cuales participa el oxígeno, el enlace covalente y la polaridad son característicos. La valencia en tales moléculas depende del número de pares emergentes de electrones a los que se atraen los núcleos de diferentes átomos. En la gran mayoría de los compuestos, los átomos de oxígeno participan en la creación de dos enlaces covalentes. Por ejemplo, en óxidos de CO 2 , P 2 O 5 , SO 2 , SO 3 , K 2 O, B 2 O 3 , Mo 2 O 5 y en otras moléculas. En el catión de hidroxonio, el oxígeno de H $ ₃ $ O $ presenta una valencia atípica III para el mismo. La presencia del grupo peroxo -O-O- se debe a la naturaleza inusual del peróxido de hidrógeno H2O2. En este compuesto, el oxígeno exhibe su valencia intrínseca II.
¿Cómo determinar la valencia de los elementos?
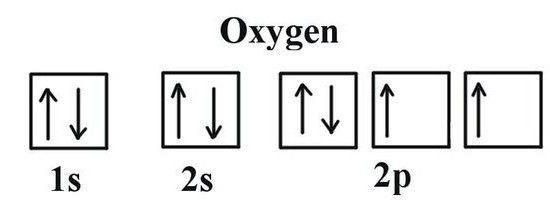
La idea de las posibilidades de valencia del oxígeno viene dada por la estructura de Lewis, el signo químico del elemento, alrededor del cual los electrones de la capa externa marcan los puntos. Están involucrados en la creación de moléculas, son parte de los pares electrónicos comunes. La fórmula de Lewis demuestra claramente la valencia de oxígeno, correspondiente al número de sus electrones no apareados (2). El mismo resultado es proporcionado por el uso de estructuras electrónicas gráficas. En dos células del nivel de energía externa de oxígeno, se encuentran electrones no emparejados (indicados por las flechas en la fórmula). La información sobre la valencia del oxígeno permite determinar el valor de los átomos vecinos a partir de la fórmula del compuesto binario acabado. Para ello se realizan cálculos sencillos. Primero, el número de átomos de O se multiplica por el exponente del oxígeno de valencia usual. El valor resultante debe dividirse por el índice, que se indica en la fórmula junto al símbolo químico del otro elemento en relación con el oxígeno. Usando un método simple, calculamos la valencia del carbono y del fósforo en sus óxidos.
- Multiplicamos el subíndice a la derecha del signo de 0 en dióxido de CO 2 por la valencia típica del elemento: 2 • 2 = 4. El número dividido se divide por el índice indicado para el carbono: 4/1 = 4. En el dióxido de carbono, el carbono está en su estado de valencia más alto IV .
- El índice en la parte inferior derecha del símbolo químico del oxígeno en óxido de fósforo P 2 O 5 se multiplica por la valencia típica del átomo O: 5 • 2 = 10. Dividimos este número por el índice indicado en la fórmula a la derecha debajo del átomo de fósforo: 10/2 = 5. En óxido, Está en el estado de su valencia más alta V.