monóxido de carbono, también conocido como monóxido de carbono, tiene una estructura molecular muy fuerte, es inerte a las propiedades químicas y es poco soluble en agua. Este compuesto también es extremadamente tóxico cuando se libera en el sistema respiratorio está conectado a la hemoglobina de la sangre, y se detiene el transporte de oxígeno a los tejidos y órganos.
Nombre químico y la fórmula
El monóxido de carbono también se conoce por otros nombres, incluyendo monóxido de carbono II. En la vida diaria, se le suele llamar monóxido de carbono. Este monóxido de carbono es un gas venenoso, incoloro y sin sabor, sin olor. Su fórmula química – CO, y la masa de una única molécula es 28,01 g / mol.

Efectos en el cuerpo
El monóxido de carbono se une a la hemoglobina para formar carboxihemoglobina que no está oxígeno capacidad de carga. La inhalación de vapor causa daño en el SNC (sistema nervioso central), y la asfixia. La consiguiente falta de oxígeno causa dolor de cabeza, mareos, disminución de la frecuencia cardíaca y frecuencia respiratoria, lo que lleva a la muerte inconsciencia y posterior del organismo.

gas tóxico
El monóxido de carbono es producido por la combustión parcial de sustancias que contienen carbono, como por ejemplo en motores de combustión interna. El compuesto 1 incluye un átomo de carbono unido covalentemente a un átomo de oxígeno. El monóxido de carbono es altamente tóxico, y es una de las causas más comunes de envenenamiento fatal en todo el mundo. La exposición podría provocar daños en el corazón y otros órganos.
¿Cuál es el uso de monóxido de carbono?
A pesar de su toxicidad grave, monóxido de carbono es extremadamente útil – gracias a la tecnología moderna de la misma para crear una amplia gama de productos vitales. El monóxido de carbono aunque hoy en día se considera un contaminante siempre presente en la naturaleza, pero no en una cantidad tal como, por ejemplo, dióxido de carbono.
Se equivocan los que creen que no hay conexión de monóxido de carbono en la naturaleza. CO disuelto en la roca volcánica fundido a altas presiones en el manto de la tierra. El contenido de óxidos de carbono en los gases volcánicos varía desde menos de 0,01% a 2%, en función del volcán. Desde natural de este compuesto no es un valor constante, para medir con precisión las emisiones de gases naturales no es posible.

propiedades químicas
El monóxido de carbono (fórmula CO) se refiere a nesoleobrazuyuschim o óxidos indiferentes. Sin embargo, a una temperatura de 200 ° C reacciona con hidróxido de sodio. Durante este proceso químico es la formación de formiato de sodio:
NaOH + CO = HCOONa (sal del ácido fórmico).
Propiedades de monóxido de carbono basados en su capacidad de resistencia. Monóxido de Carbono:
- se puede hacer reaccionar con el oxígeno: 2CO + O 2 = 2CO 2;
- capaz de reaccionar con halógenos: CO + Cl 2 = COCl 2 (fosgeno);
- Tiene la propiedad única para recuperar metales puros a partir de sus óxidos: Fe 2 O 3 + 3CO = 2Fe + 3CO 2;
- formar carbonilos metálicos: Fe + 5CO = Fe (CO ) 5;
- perfectamente soluble en cloroformo, ácido acético, etanol, benceno e hidróxido de amonio.
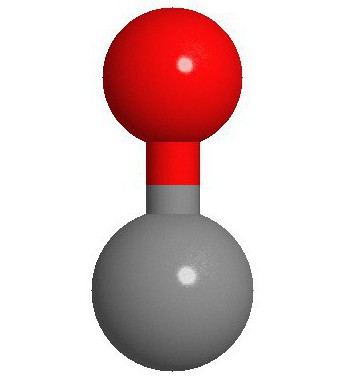
La estructura de la molécula
Dos átomos de los que, de hecho, es una molécula de monóxido de carbono (CO), triple enlace vinculado. Dos de ellos están formados por la fusión de p-electrones de los átomos de carbono con el oxígeno, y la tercera – gracias al mecanismo especial debido a 2p carbono libre pares orbitales y la 2p electrones de oxígeno. Esta estructura proporciona una molécula de alta resistencia.
Un poco de historia
Aristóteles de la antigua Grecia describe los humos tóxicos producidos por la quema de carbón. El propio mecanismo de la muerte era desconocida. Sin embargo, uno de los antiguos métodos de castigo era un conflicto de bloqueo con la ley en la sala de vapor, donde las brasas eran. El médico griego Galeno sugirió que en el aire hay ciertos cambios que causan daño si se inhala.
Durante la Segunda Guerra Mundial, la mezcla de gas con impurezas de monóxido de carbono, se utilizó como un combustible para vehículos en aquellas partes del mundo, donde había una cantidad limitada de la gasolina y combustible diesel. externo (con algunas excepciones) se han establecido los generadores de carbón o gas de madera, sino una mezcla de nitrógeno atmosférico, monóxido de carbono y pequeñas cantidades de otros gases suministrados al mezclador de gas. Este fue el llamado gas de madera.

La oxidación de monóxido de carbono
El monóxido de carbono producido en la oxidación parcial de compuestos carbonosos. CO se forma cuando insuficiente oxígeno para producir dióxido de carbono (CO 2), por ejemplo, durante el funcionamiento del horno o en el motor de combustión interna en un espacio cerrado. Si el oxígeno está presente, así como alguna otra concentración atmosférica de quemaduras de monóxido de carbono, irradiando luz azul, formando dióxido de carbono, conocido como dióxido de carbono.
El dióxido de carbono es ampliamente utilizado hasta la década de 1960 del siglo pasado para las instalaciones de iluminación interior, la cocina y la calefacción, la que tuvo con una parte del combustible como un componente prioritario. Algunos procesos en las tecnologías modernas tales como la fundición de hierro todavía producen monóxido de carbono como subproducto. La conexión en sí CO se oxida a CO 2 a temperatura ambiente.
¿Hay un CO en la naturaleza?
Si hay monóxido de carbono en la naturaleza? Una de sus fuentes de origen natural son reacciones fotoquímicas en la troposfera. Estos procesos se supone que son capaces de generar aproximadamente 5 x 10 agentes kg de diciembre de E; oday. Entre otras fuentes, como se mencionó anteriormente, son volcanes, incendios forestales y otros tipos de combustión.
propiedades moleculares
El monóxido de carbono tiene una masa molar de 28,0, lo que hace que sea menos denso que el aire. Longitud de enlace entre dos átomos – 112,8 micrómetros. Es lo suficientemente cerca como para proporcionar uno de los enlaces químicos más fuertes. Ambos elementos en conjunción con CO tienen alrededor de 10 electrones en la capa de valencia de uno.
Como regla general, el carbonilo orgánicos compuestos hay un doble enlace. Un rasgo característico de la molécula de CO es lo que se produce entre átomos fuertes electrones compartidos triple enlace con 6 3 orbitales moleculares asociados. Desde cuatro de los electrones compartidos originados por un átomo de oxígeno y 2 sólo de carbono, uno ocupado por dos electrones orbitales asociadas de O 2, formando un dipolo o enlace dativo. Esto provoca C ← O polarización de las moléculas con una pequeña carga "-" sobre carbono y una pequeña carga "+" en el oxígeno.
Los dos orbitales asociados restantes está ocupada por una partícula cargada de carbono y uno de oxígeno. La molécula es asimétrico: el oxígeno tiene una densidad de electrones mayor que de carbono y también se carga ligeramente positiva, en comparación con un carbono negativo.
recepción
En la industria, la obtención de monóxido de carbono CO se lleva a cabo por calentamiento del dióxido de carbono sin acceso de aire o de vapor de agua con carbón:
CO 2 + C = 2CO;
H 2 O + C = CO + H 2.
Este último también se llama la mezcla resultante era de vapor o gas de síntesis. En condiciones de laboratorio, monóxido de carbono II sometiendo el ácido orgánico de ácido sulfúrico concentrado, que actúa como un agente de deshidratación:
HCOOH = CO + H 2 O;
H 2 C 2 O 4 = CO 2 + H 2 O.
Los principales síntomas y ayuda con el envenenamiento por CO
Hace envenenamiento por monóxido de carbono? Sí, y muy fuerte. envenenamiento por monóxido de carbono es el fenómeno más común en todo el mundo. Los síntomas más comunes son:
- una sensación de debilidad;
- náuseas;
- mareos;
- fatiga;
- irritabilidad;
- falta de apetito;
- dolor de cabeza;
- desorientación;
- visión borrosa;
- vómitos;
- desmayo;
- convulsiones.
La exposición a este gas tóxico puede causar un daño significativo, que a menudo puede conducir a condiciones patológicas crónicas a largo plazo. El monóxido de carbono es capaz de causar daños graves al feto de una mujer embarazada. Las víctimas, por ejemplo, después de un incendio, deben proporcionar ayuda inmediata. una necesidad urgente para llamar a una ambulancia, dar acceso al aire libre, ropa limpia que dificultan la respiración, calmar, cálido. La intoxicación grave se trata generalmente sólo bajo la supervisión de médicos en el hospital.
solicitud
El monóxido de carbono es, como ya se ha mencionado, es tóxico y peligroso, pero es uno de los compuestos básicos que se utilizan en la industria moderna para la síntesis orgánica. CO se utiliza para producir metales puros, carbonilos, fosgeno, sulfuro de carbono, alcohol metílico, formamida, aromáticos aldehídos, fórmico ácido. Esta sustancia se utiliza también como combustible. A pesar de su toxicidad y toxicidad, se utiliza a menudo como una materia prima para la producción de diversas sustancias en la industria química.
Monóxido de carbono y dióxido de carbono: ¿cuál es la diferencia?
Monóxido y dióxido de carbono (CO y CO 2) a menudo se confunden entre sí. Ambos gases son inodoros, incoloros, y ambos tienen un impacto negativo sobre el sistema cardiovascular. Ambos gases pueden entrar en el cuerpo a través de la inhalación, la piel y los ojos. Estos compuestos cuando se expone a los organismos vivos comparten una serie de síntomas – dolores de cabeza, mareos, convulsiones y alucinaciones. La mayoría de la gente casi no hacen la diferencia y no se dan cuenta que los gases de los automóviles emitidos en forma de CO y CO2. En el interior del aumento de la concentración de estos gases pueden ser peligrosos para la salud humana y la seguridad, sujeto a su influencia. ¿Cuál es la diferencia?
A altas concentraciones de ambos puede ser fatal. La diferencia radica en que el CO 2 es un gas natural común, necesario para toda la vida vegetal y animal. CO no es un lugar común. Esta combustión subproducto libre de oxígeno. La diferencia química crítico ser que el CO 2 tiene un átomo de carbono y dos átomos de oxígeno, mientras que sólo ellos CO uno por uno. El dióxido de carbono no es inflamable, mientras que el monóxido es más probable que se prenda fuego.
El dióxido de carbono se encuentra naturalmente en la atmósfera, las personas y los animales respiran oxígeno y dióxido de carbono exhalado, es decir, seres que puede soportar una pequeña cantidad. También se requiere Este gas para la fotosíntesis por las plantas. Sin embargo, el monóxido de carbono no se produce naturalmente en la atmósfera, y puede causar problemas de salud incluso a bajas concentraciones. Tanto la densidad del gas es también diferente. El dióxido de carbono es más pesado y más denso que el aire, mientras que el monóxido de carbono es un poco más fácil. Esta peculiaridad se tiene en cuenta en el establecimiento de los sensores apropiados en los hogares.