Concentración y densidad del ácido sulfúrico. Dependencia de la densidad del ácido sulfúrico sobre la concentración en la batería del automóvil
El ácido sulfúrico diluido y concentrado son productos químicos tan importantes que en el mundo se producen más que cualquier otra sustancia. La riqueza económica de un país puede estimarse por el volumen de ácido sulfúrico producido en él.
El proceso de disociación
El ácido sulfúrico se utiliza en forma de soluciones acuosas de diversas concentraciones. Sufre una reacción de disociación en dos etapas, produciendo iones H + en solución.
H _ { 2} SO _ { 4 } = H + + HSO _ { 4} – ;
HSO _ { 4 } – = H + + SO _ { 4} – 2 .
El ácido sulfúrico es fuerte, y la primera etapa de su disociación es tan intensa que casi todas las moléculas originales se dividen en iones H + y iones HSO 4-1 (sulfato de hidrógeno) en la solución. Estos últimos se descomponen parcialmente, liberando otro ion H + y dejando el ion sulfato (SO 4-2 ) en solución. Sin embargo, el sulfato de hidrógeno, siendo un ácido débil, todavía prevalece en solución sobre H + y SO $ ₄ $ -2 . La disociación completa de la misma ocurre solamente cuando la densidad de la solución de ácido sulfúrico se aproxima a la densidad de agua, es decir , bajo dilución fuerte. 
Propiedades del ácido sulfúrico
Es especial en el sentido de que puede actuar como un ácido normal o como un oxidante fuerte – dependiendo de su temperatura y concentración. Una solución diluida fría de ácido sulfúrico reacciona con los metales activos para producir una sal (sulfato) y la evolución de un gas hidrógeno. Por ejemplo, la reacción entre el H 2 SO 4 diluido en frío (asumiendo su disociación completa en dos etapas) y el zinc metálico tiene este aspecto:
Zn + H _ { 2} SO _ { 4 } = ZnSO _ { 4 } + H _ { 2} .
Se concentra ácido sulfúrico caliente, cuya densidad es de aproximadamente 1,8 g / cm3, puede actuar como oxidante, reaccionando con materiales que son usualmente inertes a ácidos, tales como, por ejemplo, cobre metálico. Durante la reacción, el cobre se oxida y la masa de ácido disminuye, se forma una solución de sulfato de cobre (II) en agua y gas dióxido de azufre (SO2) en lugar de hidrógeno, lo que se esperaría cuando el ácido reaccione con el metal.
Cu + 2H _ { 2} SO _ { 4 } = CuSO _ { 4 } + SO _ { 2 } + 2H _ { 2 } O. 
¿Cómo la concentración de soluciones
En realidad, la concentración de cualquier solución se puede expresar de varias maneras, pero la más utilizada es la concentración de peso. Muestra el número de gramos de soluto en una masa o volumen específico de la solución o disolvente (típicamente 1000 g, 1000 cc, 100 cc y 1 dm3). En lugar de la masa de la sustancia en gramos, se puede tomar su cantidad, expresada en moles, – entonces se obtiene una concentración molar por 1000 g o 1 dm 3 de solución.
Si la concentración molar se determina en relación no a la cantidad de la solución, sino sólo al disolvente, se denomina molalidad de la solución. Se caracteriza por la independencia de la temperatura.
A menudo, la concentración en peso se indica en gramos por 100 g de disolvente. Multiplicando esta cifra por el 100%, consígalo en el porcentaje del peso (concentración del porcentaje). Es este método que se usa con mayor frecuencia en la aplicación a soluciones de ácido sulfúrico.
Cada valor de la concentración de la solución, determinado a una temperatura dada, corresponde a una densidad muy específica (por ejemplo, la densidad de una solución de ácido sulfúrico). Por lo tanto, a veces la solución se caracteriza por ella. Por ejemplo, una solución de H2SO4, caracterizada por una concentración porcentual del 95,72%, tiene una densidad de 1,835 g / cm3 a t = 20ºC. ¿Cómo determinar la concentración de tal solución, si sólo se da la densidad del ácido sulfúrico? Una tabla que da tal correspondencia es una parte integral de cualquier libro de texto sobre química general o analítica.
Ejemplo de cálculo de conversión
Tratemos de pasar de una forma de expresar la concentración de la solución a otra. Supongamos que tenemos una solución de H2SO4 En agua con un porcentaje de concentración del 60%. En primer lugar, determinar la densidad adecuada de ácido sulfúrico. A continuación se muestra una tabla que contiene los porcentajes (la primera columna) y las densidades correspondientes de una solución acuosa de H2SO4 (cuarta columna). 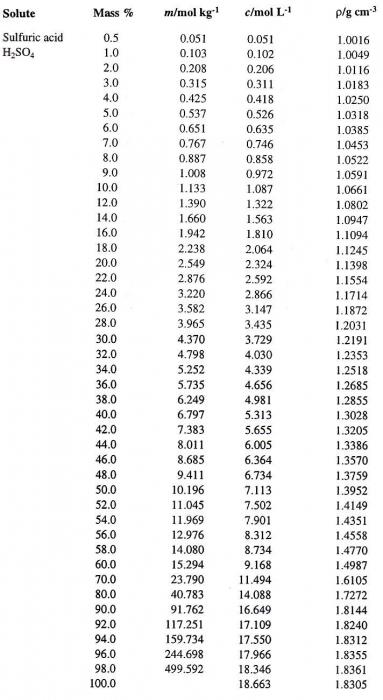
En ella se determina el valor requerido, que es igual a 1,4987 g / cm 3 . Ahora calculamos la molaridad de esta solución. Para ello, es necesario determinar la masa de H2SO4 En 1 litro de solución y el número correspondiente de moles de ácido.
El volumen que ocupa 100 g de la solución madre:
100 / 1,4987 = 66,7 ml.
Dado que en 66,7 mililitros de una solución al 60% contiene 60 g de ácido, en 1 litro contendrá:
(60/66,7) x 1000 = 899, 55 g.
El peso molar del ácido sulfúrico es 98. Por lo tanto, el número de moles contenidos en 899,55 gramos de gramos será:
899,55 / 98 = 9,18 mol.
La dependencia de la densidad del ácido sulfúrico sobre la concentración se muestra en la Fig. A continuación. 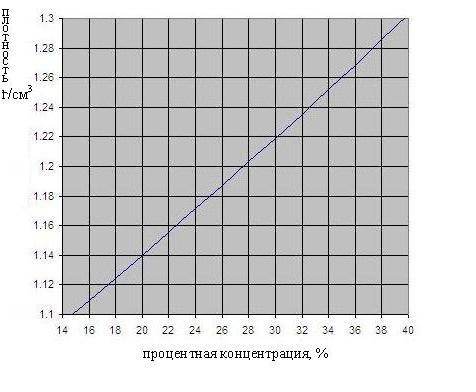
Uso de ácido sulfúrico
Se utiliza en varias industrias. En la producción de hierro y acero se utiliza para limpiar la superficie metálica antes de recubrirla con otra sustancia, participa en la creación de tintes sintéticos, así como otros tipos de ácidos, como el clorhídrico y el nítrico. También se utiliza en la fabricación de productos farmacéuticos, fertilizantes y explosivos, y también es un reactivo importante para eliminar las impurezas del petróleo en la industria del refinado de petróleo.
Este producto químico es increíblemente útil en la vida cotidiana y está fácilmente disponible como una solución de ácido sulfúrico usada en baterías de plomo-ácido (por ejemplo, las que están en los coches). Dicho ácido tiene generalmente una concentración de aproximadamente 30% a 35% de H2SO4 en peso, el resto es agua.
Para muchas aplicaciones domésticas, el 30% de H2SO4 será más que suficiente para satisfacer sus necesidades. Sin embargo, se requiere una concentración mucho mayor de ácido sulfúrico en la industria. Generalmente en el proceso de producción, primero se obtiene suficientemente diluido y contaminado con inclusiones orgánicas. El ácido concentrado se obtiene en dos etapas: primero se lleva hasta el 70%, y luego – en la segunda etapa – se eleva al 96-98%, que es el indicador limitante para la producción económicamente rentable.
La densidad del ácido sulfúrico y sus variedades
Aunque casi el 99% de ácido sulfúrico se puede obtener brevemente al hervir, pero la pérdida subsiguiente de SO $ ₃ $ en el punto de ebullición conduce a una disminución de la concentración al 98,3%. En general, la variedad con un indicador del 98% es más estable en almacenamiento.
Los grados de producto del ácido difieren en su concentración porcentual, y para ellos se eligen los valores elegidos para los que las temperaturas de cristalización son mínimas. Esto se hace para reducir la precipitación de cristales de ácido sulfúrico en el sedimento durante el transporte y almacenamiento. Las principales variedades son:
- Torre (nitrosis) – 75%. La densidad del ácido sulfúrico en esta clase es 1670 kg / m 3 . Obtener lo que se llama. Método Nitroses, en el que el gas de combustión, que contiene dióxido de azufre SO 2 , obtenido en la cocción de la materia prima primaria, es tratado con nitrosas (también H2SO4, pero con óxidos de nitrógeno disueltos en él) en las torres revestidas. Como resultado, se liberan óxidos de ácido y nitrógeno, que no se consumen en el proceso, sino que vuelven al ciclo de producción.
- Contacto – 92,5-98,0%. La densidad del ácido sulfúrico del 98% de esta variedad es de 1836,5 kg / m3. También se obtiene a partir de un gas calcinado que contiene SO2, comprendiendo el proceso la oxidación del dióxido a un anhídrido SO3 al contacto (de ahí el nombre de la variedad) con varias capas de un catalizador sólido de vanadio.
- Oleum – 104,5%. Su densidad es igual a 1896,8 kg / m 3 . Esta solución de SO $ ₃ $ en H $ ₂ $ SO $ ₄ $ , en la que el primer componente contiene 20% y los ácidos, es 104,5%.
- Oleum de alto interés – 114,6% . Su densidad es de 2002 kg / m 3 .
- Recargable – 92-94%.
¿Cómo es la batería del coche
El trabajo de este uno de los dispositivos electrotécnicos más masivos está completamente basado en procesos electroquímicos que ocurren en presencia de una solución acuosa de ácido sulfúrico.
La batería del coche contiene electrolito de ácido sulfúrico diluido, así como electrodos positivos y negativos en forma de varias placas. Las placas positivas están hechas de material marrón rojizo – dióxido de plomo (PbO 2 ), y las negativas están hechas de plomo gris "esponjoso" (Pb).
Debido a que los electrodos están hechos de plomo o material que contiene plomo, este tipo de batería se llama a menudo una batería de plomo-ácido. Su eficiencia, es decir, la magnitud de la tensión de salida, es determinada directamente por la densidad de corriente de ácido sulfúrico (kg / m3 o g / cm3) llenado en la batería como electrolito.
¿Qué sucede con el electrolito cuando se descarga la batería?
El electrolito de la batería de plomo-ácido es una solución de almacenamiento de ácido sulfúrico en agua destilada químicamente pura con un porcentaje de concentración del 30% cuando está completamente cargada. El ácido puro tiene una densidad de 1.835 g / cm3, el electrolito es de aproximadamente 1.300 g / cm3. Cuando se descarga la batería, se producen reacciones electroquímicas en ella, como resultado de lo cual el ácido sulfúrico se extrae del electrolito. La densidad de la concentración de la solución depende casi proporcionalmente, por lo que debería disminuir debido a una disminución en la concentración de electrolitos.
Mientras la corriente de descarga fluya a través de la batería, el ácido cerca de sus electrodos se utiliza activamente, y el electrolito se diluye más. La difusión de ácido del volumen de todo el electrolito y de las placas de electrodo mantiene aproximadamente la intensidad constante de las reacciones químicas y, como consecuencia, el voltaje de salida.
Al comienzo del proceso de descarga, la difusión de ácido del electrolito a las placas se produce rápidamente porque el sulfato formado así no bloquea todavía los poros en el material activo de los electrodos. Cuando el sulfato comienza a formar y llenar los poros de los electrodos, la difusión ocurre más lentamente.
Teóricamente, usted puede continuar la descarga hasta que todo el ácido se utiliza, y el electrolito consistirá en agua pura. Sin embargo, la experiencia demuestra que las descargas no deben continuar después de que la densidad del electrolito haya caído a 1.150 g / cm 3 .
Cuando la densidad cae de 1.300 a 1.150, esto significa que se ha formado tanto sulfato durante las reacciones y llena todos los poros de los materiales activos de las placas, es decir, casi todo el ácido sulfúrico ya se ha eliminado de la solución. La densidad depende de la concentración, y la carga depende de la densidad. En la Fig. La dependencia de la carga de la batería sobre la densidad del electrolito se muestra a continuación. 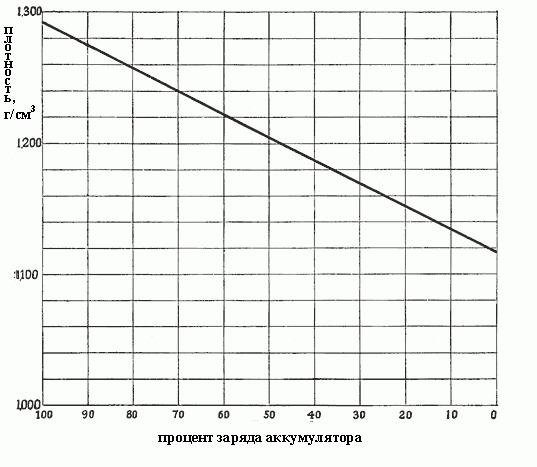
Cambiar la densidad del electrolito es la mejor manera de determinar el estado de la descarga de la batería, siempre y cuando se utilice correctamente.
Grados de descarga de una batería de automóvil dependiendo de la densidad del electrolito
Su densidad debe ser medida cada dos semanas y un registro de lecturas debe ser guardado para uso futuro.
Cuanto más denso es el electrolito, más ácido contiene y más cargada la batería. La densidad de 1.300-1.280 g / cm3 indica la carga total. Por regla general, los siguientes grados de descarga de la batería difieren dependiendo de la densidad del electrolito:
- 1,300-1,280 – completamente cargado:
- 1.280-1.200 – más de la mitad descargado;
- 1.200-1.150 – menos de la mitad cargada;
- 1.150 – prácticamente descargado.
Para una batería completamente cargada, antes de conectar su red de automóviles, la tensión de cada célula es de 2,5 a 2,7 V. Una vez que la carga está conectada, la tensión cae rápidamente a alrededor de 2,1 V durante tres o cuatro minutos. Esto se debe a la formación de una capa delgada de sulfato de plomo en la superficie de las placas de electrodo negativo y entre la capa de peróxido de plomo y el metal de las placas positivas. El valor final de la tensión de la celda después de la conexión a la red automotriz es de aproximadamente 2,15-2,18 voltios.
Cuando la corriente comienza a fluir a través de la batería durante la primera hora de funcionamiento, se produce una caída de tensión de hasta 2 V, debido al aumento de la resistencia interna de las células debido a la formación de una mayor cantidad de sulfato que llena los poros de las placas y la eliminación del ácido del electrolito. Poco antes de que fluya la corriente, la densidad del electrolito es máxima e igual a 1.300 g / cm3. Inicialmente, su rarefacción se produce rápidamente, pero luego se establece un estado equilibrado entre la densidad de ácido cerca de las placas y en el volumen principal del electrolito, la extracción ácida por electrodos es soportada por la llegada de nuevas partes ácidas de la parte principal del electrolito. Al mismo tiempo, la densidad media del electrolito continúa disminuyendo constantemente de acuerdo con la dependencia mostrada en la Fig. Más alto. Después de la caída inicial, la tensión disminuye más lentamente, la tasa de su disminución depende de la carga de la batería. La gráfica de tiempo del proceso de descarga se muestra en la Fig. A continuación. 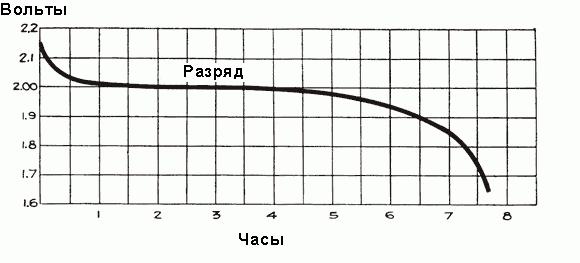
Control del electrolito en la batería
Se utiliza un densímetro para determinar la densidad. Consiste en un pequeño tubo de vidrio sellado con una extensión en el extremo inferior, lleno de tiro o mercurio, y una escala graduada en el extremo superior. Esta escala está marcada de 1.100 a 1.300 con diferentes valores intermedios, como se muestra en la Fig. A continuación. Si este hidrómetro se coloca en el electrolito, caerá a una cierta profundidad. En este caso, desplazará un cierto volumen de electrolito, y cuando se alcance la posición de equilibrio, el peso del volumen desplazado será simplemente igual al peso del hidrómetro. Puesto que la densidad del electrólito es igual a la relación de su peso respecto al volumen, y el peso del hidrómetro es conocido, cada nivel de su inmersión en la solución corresponde a una cierta densidad. 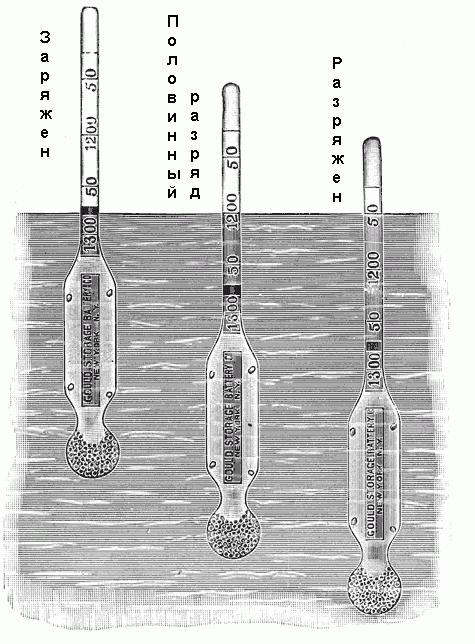 Algunos areómetros no tienen una escala con valores de densidad, pero están etiquetados como "cargado", "medio descargado", "descarga completa" o similar.
Algunos areómetros no tienen una escala con valores de densidad, pero están etiquetados como "cargado", "medio descargado", "descarga completa" o similar.
















