Enlace metálico: el mecanismo de formación. Química de metales de comunicación:
Todos los elementos químicos conocidos actualmente en la tabla periódica están divididas arbitrariamente en dos grupos: metales y no metales. Para llegar a ser no sólo elementos y compuestos, los productos químicos pueden reaccionar unos con otros, deben existir en la forma de compuestos simples y complejos.
Por eso, algunos electrones están tratando de adoptar, y el otro – a dar. La reposición de uno al otro de manera que forman diversos elementos y moléculas químicas. Pero lo que les permite mantenerse juntas? ¿Por qué hay una cuestión de fuerza tal, para destruir que trasciende incluso los instrumentos más graves? Y otros, por el contrario, son destruidos por el menor impacto. Todo esto es debido a la formación de varios tipos de enlaces químicos entre los átomos en las moléculas que forman la estructura específica de la red cristalina.
Tipos de enlaces químicos en los compuestos
Total puede distinguir cuatro tipos principales de enlaces químicos.
- no polar covalente. Formado entre dos elementos no metálicos idénticos debido a la compartición de electrones, formando pares de electrones comunes. En la educación, cuando se hallen presentes partículas de valencia no apareados. Ejemplos: halógenos, oxígeno, hidrógeno, nitrógeno, azufre, fósforo.
- covalente polar. Formado entre dos no metales diferentes o entre muy débil en las propiedades del metal y no metal débil en electronegatividad. pares de electrones subyacente y generales y tirando de ellos a su átomo, cuya afinidad por encima de electrones. Ejemplos: NH 3, SiC, P 2 O 5 y otra.
- enlace de hidrógeno. El más inestable y débil, está formada entre el átomo altamente electronegativo de una molécula y el otro positivo. Esto ocurre más a menudo cuando se disuelven sustancias en agua (alcohol, amoniaco y así sucesivamente). Debido a una conexión de este tipo puede existir proteínas de macromoléculas, ácidos nucleicos, carbohidratos complejos, y así sucesivamente.
- Enlace iónico. Formado debido a fuerzas atractivas iones metálicos raznozaryazhennyh electrostáticas y no metales. Cuanto mayor sea la diferencia en este índice, más pronunciada es la naturaleza iónica de la interacción. Ejemplos de compuestos: sal binario, complejo de compuesto – alcalino.
- Enlace metálico, que el mecanismo de formación y propiedades que serán discutidos más. Formado en metales, sus aleaciones de diversos tipos.
Hay una cosa tal como la unidad de la unión química. Sólo dice que es imposible considerar cada punto de referencia de bonos. Todos ellos son sólo el símbolo de la unidad. Después de todo, la base de todas las interacciones es un principio único – elektronnostaticheskoe interacción. Por lo tanto, iónico, metálico, unión covalente e hidrógeno tienen una sola naturaleza química y sólo son casos límite entre sí.
Los metales y sus propiedades físicas
Los metales se encuentran en la gran mayoría de todos los elementos químicos. Esto se debe a sus propiedades especiales. Una parte significativa de los cuales se obtuvo por una persona por las reacciones nucleares en el laboratorio, que son radiactivos con vida media corta.
Sin embargo, la mayoría – son elementos naturales que forman el conjunto de rocas y minerales, son parte de los compuestos más importantes. Es a causa de estas personas han aprendido a emitir aleaciones y producir una gran cantidad de productos excelentes e importantes. Esto es, tal como cobre, hierro, aluminio, plata, oro, cromo, manganeso, níquel, zinc, plomo y otros.
Para todos los metales pueden identificar las propiedades físicas comunes que explica la formación de enlace metálico diagrama. ¿Cuáles son esas características?
- Maleabilidad y ductilidad. Se sabe que muchos metales se pueden rodar hacia abajo hasta el punto de lámina (oro, aluminio). De los otros reciben un alambre, láminas flexibles de metal, artículos capaces deformados por impacto físico, pero entonces recuperarse de su terminación. Estas son las cualidades de los metales y se llama maleabilidad y ductilidad. La razón de esta característica – un tipo de enlace de metal. Los iones y electrones en el cristal de deslizamiento respecto a la otra sin romper, lo que permite preservar la integridad de toda la estructura.
- brillo metálico. Esto también explica el enlace metálico, el mecanismo de formación de sus características y funciones. Por lo tanto, no todas las partículas son capaces de absorber o reflejar ondas de luz de igual longitud. Átomos mayoría de los metales y reflejar de onda corta rayos se vuelven sustancialmente uniforme color plateado, blanco, pálido tono azulado. Las excepciones son el cobre y el oro, su color es amarillo rojizo y rojo, respectivamente. Son capaces de reflejar la radiación de longitud de onda más larga.
- conductividad térmica y eléctrica. Estas propiedades también explican la estructura reticular cristalina y en que su formación se realiza enlaces de tipo metálico. Debido a la "gas de electrones" se mueve dentro del cristal, la corriente eléctrica y el calor rápida y uniformemente distribuidas entre todos los átomos y los iones y llevan a cabo a través del metal.
- El estado agregado sólido en condiciones normales. En este caso, la única excepción es el mercurio. Todos los otros metales – es conexiones necesariamente fuertes, sólidos, así como sus aleaciones. También es el resultado del hecho de que en presencia de unión de metal metal. El mecanismo de formación de este tipo de propiedades de unión de partículas completamente confirmado.
Este básicas características físicas de los metales, lo que explica y determina la formación de enlace metálico exactamente diagrama. compuestos relevantes de tales métodos es a átomos de metal de los elementos, de sus aleaciones. Esto es para ellos un sólido y un estado líquido.

tipo metálico de enlace químico
¿Cuál es su función? Lo que pasa es que tal relación se forma no por iones raznozaryazhennyh y la atracción electrostática y no debido a la diferencia en electronegatividad y la disponibilidad de los pares de electrones libres. Es decir iónico, metálico, enlace covalente tienen varios naturaleza diferente y características distintivas de partículas de enlace.
Todos los metales son características inherentes, tales como:
- una pequeña cantidad de electrones en el nivel de energía exterior (excepto por algunas excepciones, para los que no puede ser 6,7 y 8);
- radio atómico grande;
- energía de ionización baja.
Todo esto contribuye a facilitar la separación de electrones no apareados en el núcleo externo. En este caso, los orbitales libres del átomo queda mucho. Esquema del enlace metálico simplemente mostrará múltiples celdas superpuestas de diferentes átomos de orbitales entre ellos, que resultan en la intracristalino y formar un espacio común. Sirve electrones de cada átomo que comienzan libremente pasear en diferentes partes de la red. Periódicamente, cada uno de los cuales está unido a un ion en la unidad de cristal y la convierte en un átomo y luego se separaron de nuevo, ion de conformación.
Por lo tanto, el enlace metálico – es el enlace entre los átomos, iones y electrones libres en el cristal de metal total. La nube de electrones, moverse libremente dentro de la estructura, se hace referencia como "gas de electrones". Se explicó a ellos, la mayoría de las propiedades físicas de los metales y sus aleaciones.
¿Cómo específicamente implementa un enlace químico metálico? Ejemplos son diferentes. Vamos a considerar un pedazo de litio. Incluso si se toma el tamaño de un guisante, hay miles de átomos. Así que imaginemos que cada uno de estos miles de átomos da un electrón de valencia en un solo espacio cristalina común. Al mismo tiempo, conociendo la estructura electrónica del elemento, se puede ver el número de orbitales vacantes. En su litio es 3 (el segundo nivel de energía orbital p). Tres cada átomo de decenas de miles – este es un espacio común dentro del cristal, en el que el "gas electrónico" se mueve libremente.

Sustancia siempre fuerte enlace metálico. Después de todo, el gas de electrones no permite que el cristal caiga, pero sólo desplaza las capas y luego se recupera. Es escarcha tiene una cierta densidad (generalmente alta), fusibilidad, maleabilidad y ductilidad.
¿Dónde más se dio cuenta de enlace metálico? Ejemplos de sustancias:
- metales como estructuras simples;
- todas las aleaciones de metal entre sí;
- todos los metales y sus aleaciones en estado líquido y sólido.
Ejemplos específicos son simplemente una cantidad increíble, porque el metal en la tabla periódica, más de 80!
Enlace metálico: el mecanismo de formación
Si tenemos en cuenta que, en términos generales, los puntos principales que hemos descrito anteriormente. La disponibilidad de los orbitales atómicos y electrones fácilmente separados del núcleo debido a la baja energía de ionización – son las principales condiciones para la formación de este tipo de comunicación. Por lo tanto, parece que se implementa entre las siguientes partículas:
- átomos en la red cristalina;
- electrones libres, que estaban en la valencia del metal;
- iones en la red cristalina.
El resultado – un enlace metálico. El mecanismo de formación expresa generalmente por la siguiente entrada: Me 0 – e – ↔ Me n +. A partir del diagrama, evidentemente, todas las partículas de metal están presentes en el cristal.
Cristales sí mismos pueden tener diferentes formas. Depende del material con el que nos ocupa.
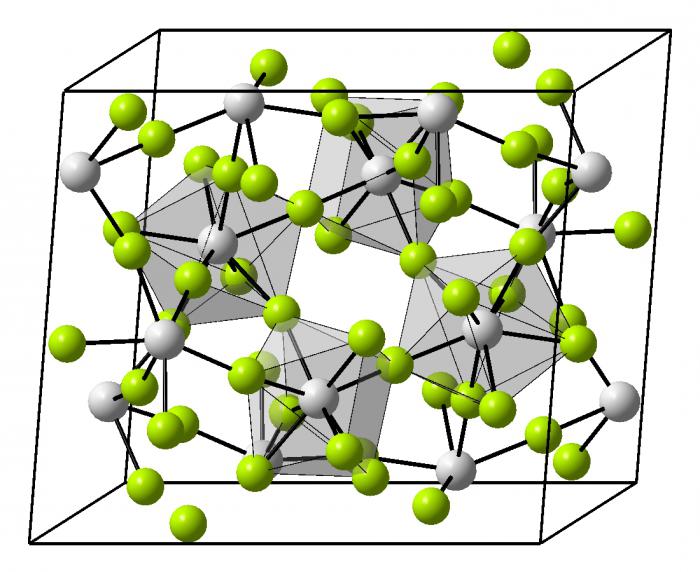
Tipos de cristales metálicos
Esta estructura del metal o su aleación tiene una muy empaquetamiento denso de partículas. Se proporciona iones en los sitios de cristal. Por sí mismos, la red puede ser de diferentes formas geométricas en el espacio.
- Obemnotsentricheskaya red cúbica – metales alcalinos.
- Hexagonal estructura compacta – todos alcalina, a excepción de bario.
- Granetsentricheskaya cúbico – aluminio, cobre, zinc, muchos metales de transición.
- estructura romboédrica – el mercurio.
- Tetragonal – indio.
Los metales pesados y la inferior se encuentra en el sistema periódico, más difícil es el envasado y la organización espacial del cristal. Cuando este enlace químico de acero, ejemplos de los cuales se puede reducir para cada metal existente es decisivo en la construcción del cristal. Aleaciones tienen una organización muy diversa en el espacio, algunos de ellos son todavía aún no está completamente entendido.

Especificaciones de comunicación: nondirectionality
Covalente y metal bono tiene un rasgo distintivo muy pronunciado. A diferencia de la primera, el enlace metálico no se dirige. ¿Qué significa? Es decir, la nube de electrones en el interior del cristal se mueve con bastante libertad dentro de ella en direcciones diferentes, cada uno de los electrones es capaz de unirse a absolutamente cualquier ion en la estructura de nodos. Es decir, la interacción se lleva a cabo en diferentes direcciones. Por lo tanto, se dice que el enlace metálico – no direccional.
El mecanismo de enlace covalente implica la formación de pares de electrones compartidos, es decir, nubes de átomos se superponen. Y se produce estrictamente en una cierta línea que une sus centros. Por lo tanto, hablando de la dirección de una conexión de este tipo.
saturabilidad
Esta característica refleja la capacidad de los átomos de una interacción limitada o ilimitada con otros. Por ejemplo, covalente y unión de metal en este indicador de nuevo son opuestos.
La primera es completa. Los átomos que intervienen en su formación son un número fijo de electrones de valencia externos que participan directamente en la formación del compuesto. Más de comer, no va a ser los electrones. Por lo tanto, el número de enlaces formados valencia limitada. Por lo tanto la saturación debido. Debido a esta característica de la mayoría de los compuestos que tiene una composición química constante.
enlaces metal y de hidrógeno, por otro lado, no saturante. Esto se debe a muchos electrones libres y orbitales dentro del cristal. El papel desempeñado por los iones en los sitios de la red cristalina, cada uno de los cuales pueden ser un átomo y un ion de nuevo en cualquier momento.

Otra característica de la unión metálica – deslocalización nube de electrones interno. Se manifiesta en la capacidad de una pequeña cantidad de electrones compartidos enlazar la pluralidad de metales de los núcleos atómicos. Es decir, la densidad de deslocalizado, ya que se distribuye uniformemente entre todas las unidades del cristal.
Ejemplos de formación de un enlace en los metales
Considere unas pocas realizaciones específicas, que ilustran, como se forma un enlace metálico. Ejemplos Los siguientes sustancias:
- zinc;
- aluminio;
- potasio;
- cromado.
formación de enlace metálico entre átomos de zinc: Zn 0 – 2e – ↔ Zn 2+. átomo de zinc tiene cuatro niveles de energía. orbitales libre basado en la estructura electrónica, que tiene 15 – 3 orbitales p, 4 D 5 y 7 en 4f. Estructura electrónica incluye: 1s 2s 2 2 2 2p 6 3s 3p 6 4s 2 3d 10 4d 4p 0 0 0 4f, sólo el 30 electrones atómicas. Es decir, dos partículas negativas de valencia libre son capaces de moverse dentro de los 15 orbitales amplias y nadie ocupada. Y así, cada átomo. El resultado – un espacio global enorme que consiste en orbitales vacíos, y una pequeña cantidad de electrones que unen a toda la estructura.
El enlace metálico entre átomos de aluminio: AL 0 – e – ↔ Al3 +. Trece átomos de electrones de aluminio situadas en tres niveles de energía, que les falta claridad en abundancia. Estructura electrónica: 1s 2s 2 2 2p 6 3s 3p 1 2 0 3d. orbitales libres – 7 piezas. Obviamente, la nube de electrones será pequeño en comparación con el espacio libre total interna en el cristal.

El cromo enlace metálico. Este elemento particular de su estructura electrónica. Después de todo, para la estabilización del fallo del sistema se produce con 4s de electrones a 3D orbital: 1s 2s 2 2p 2 6 2 3s 4s 3p 6 1 5 4p 3d 4d 0 0 0 4f. Sólo 24 de valencia de electrones de los cuales son seis. Ellos van al espacio electrónico común en la formación de un enlace químico. orbitales libres 15, que sigue siendo mucho mayor que la requerida para llenar. Por lo tanto, el cromo – como un ejemplo típico de un metal con un enlace correspondiente en la molécula.
Uno de los metales más activos que reaccionan incluso con agua ordinaria al fuego, es el potasio. Lo que explica estas propiedades? Una vez más, en muchos aspectos – de tipo metálico de enlace. Los electrones en el único elemento 19, pero que se encuentran tanto como 4 niveles de energía. Es decir 30 orbitales diferentes subniveles. Estructura electrónica: 1s 2s 2 2p 2 6 2 3s 4s 3p 6 1 0 4P 3d 4d 0 0 0 4f. Sólo dos electrones de valencia con muy baja energía de ionización. Libre de venir e ir al espacio electrónico común. Los orbitales para mover un pedazos de átomos de 22, es decir, un muy amplio espacio para el "gas de electrones".
Similitudes y diferencias con otros tipos de enlaces
En general, el tema ya ha sido discutido anteriormente. Sólo se puede generalizar y sacar una conclusión. La principal distintivo de todos los otros tipos de funciones de comunicación es el metal cristales son:
- varios tipos de partículas que participan en el proceso de unión (átomos, iones o átomos, iones, electrones);
- diferente estructura geométrica espacial de cristales.
Con hidrógeno y metal iónico combina la saciedad y no dirigida. Con covalente polar – fuerte atracción electrostática entre las partículas. Por separado, ion – partículas de tipo en los puntos de la red cristalina (iones). Con covalente no polar – átomos en los sitios de cristal.
Tipos de bonos en metales de diferente estado de agregación
Como hemos señalado anteriormente, enlace químico metálico, ejemplos de los cuales se dan en el artículo, se forma en los dos estados de agregación de metales y sus aleaciones: sólido y líquido.
La pregunta es: ¿qué tipo de conexión con el vapor de metal? R: covalente polar y no polar. Como con todos los compuestos presentes en un gas. Eso no se desgarre y la estructura de cristal se retiene durante el calentamiento prolongado del metal y la transferencia es de sólido a comunicación de líquido. Sin embargo, cuando se trata de transferir líquido a estado de vapor, el cristal se destruye y enlace metálico se convierte en covalente.

















