El grado de oxidación – que es el valor? Cómo determinar el grado de oxidación de los elementos?
Tal materia escolar como la química provoca numerosas dificultades en la mayoría de los estudiantes de hoy en día, muy pocas personas podrían determinar el grado de oxidación de los compuestos. La mayor dificultad en niños escolares que estudian química inorgánica, es decir, los alumnos de primaria (8-9 grados). malentendido objeto conduce a rechazar los escolares para el sujeto.
Los maestros asignan un número de razones para ello los alumnos "aversión" en los estudiantes de secundaria y alta en la química: la falta de voluntad para entender los términos químicos complejos, la imposibilidad de usar algoritmos para un proceso en particular, el conocimiento matemático del problema. El Ministerio de Educación se han hecho cambios importantes en el contenido de la asignatura. Además, el "corte" y el número de horas para la enseñanza de la química. Esto afectó negativamente a la calidad de los conocimientos sobre el tema, una disminución del interés en el estudio de la disciplina.

Lo que por supuesto temas de química da a los estudiantes la más difícil?
Bajo el nuevo programa en el curso de la disciplina "Química" escuela básica incluye varios temas principales: la tabla periódica de los elementos de D. I. Mendeleeva, clases de sustancias inorgánicas, de intercambio iónico. Hardest definición grado dado estado de oxidación óxidos.
reglas de colocación
En primer lugar de todos los estudiantes deben ser conscientes de que los óxidos de dos elementos son compuestos complejos, en el que la composición incluía oxígeno. Un compuesto binario requisito previo que pertenece a la clase de los óxidos es oxígeno segunda ubicación en un compuesto dado.
Calcula tales índice en se obtiene cualquier clase dada de fórmulas sólo si el estudiante tiene un algoritmo específico.
Algoritmo para óxidos ácidos
Para empezar, observamos que el grado de oxidación es una expresión numérica de la valencia de los elementos. óxidos ácidos formados no metales o metales con una valencia de cuatro miembros a siete, un segundo que se requiere en tales óxidos es oxígeno.
Los óxidos de valencia del oxígeno se corresponde siempre a dos, que pueden ser a determinar de acuerdo con elementos de la tabla periódica D. I. Mendeleeva. Esto es un no metal típico como oxígeno, mientras que en el Grupo 6 de la tabla periódica del subgrupo principal, acepta dos electrones, con el fin de completar plenamente su nivel de energía exterior. Los no metales en los compuestos de oxígeno a menudo presentan la valencia más alta que corresponde al número del grupo mismo. Es importante recordar que el grado de oxidación de los elementos químicos es un indicador suponiendo un número positivo (negativo).
de pie no metal en el comienzo de una fórmula tiene un estado de oxidación positivo. óxidos no metálicos en el, su -2 refracción estable en oxígeno. Con el fin de verificar la exactitud de la alineación de los valores en óxidos ácidos que multiplicar todos los números que puso en los índices del elemento particular. Los cálculos se considerarán válidas si se obtiene la suma total de todos los pros y los contras del conjunto 0 grados.

Preparación de fórmulas de dos elementos
El grado de oxidación de los elementos atómicos tiene la oportunidad de crear y grabar un compuesto de dos elementos. Al crear una fórmula para el inicio de ambos símbolos cerca prescrita, cuidadosamente segundo dar oxígeno. En la parte superior de cada una de las marcas grabadas valor prescrito de los grados de oxidación, a continuación, se ha encontrado entre los números es el número que va a ser sin ningún uniformemente divisible por ambos números. El indicador se debe dividir individualmente por el valor numérico del grado de oxidación para obtener índices de los componentes primero y segundo del material de dos elementos. estado de oxidación superior es numéricamente igual al valor más alto de valencia no metal típico es idéntico al número de grupo, en el que el PS es un no metal.
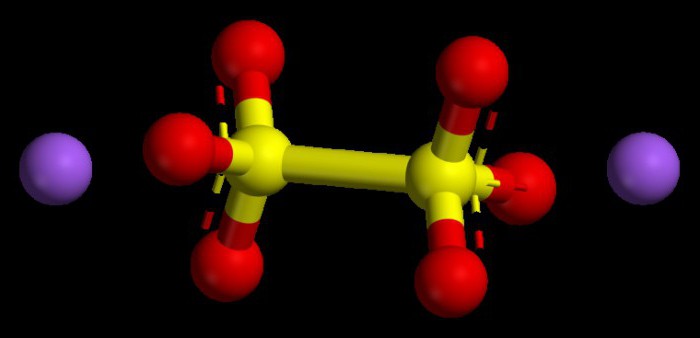
Las actuaciones algoritmo de valores numéricos en los óxidos básicos
Tales compuestos son considerados óxidos metálicos típicos. Se encuentran en todos los compuestos tenían una tasa del estado de oxidación de no más de una o dos. Con el fin de entender lo que será el grado de oxidación del metal, es posible aprovechar las ventajas del sistema periódico. En los metales los principales subgrupos del primer grupo, esta opción es siempre constante, es similar al número de grupo, que es uno.
Metales subgrupo principal del segundo grupo también se caracterizan por un estado de oxidación estable 2 numéricamente. El grado de oxidación en la cantidad de óxidos en vista de sus índices (números) debería dar cero, debido a que el producto químico se considera una molécula neutra, carente de una partícula de carga.
La alineación de la oxidación en los ácidos que contienen oxígeno
Los ácidos son sustancia compleja compuesta de uno o más átomos de hidrógeno que están asociados con algún residuo ácido. Teniendo en cuenta que el grado de oxidación es un objetivos numéricos para su cálculo requiere algunas habilidades matemáticas. Tal indicador de hidrógeno (protón) siempre estable en ácidos, es 1. Además, es posible indicar el grado de oxidación del ion negativo del oxígeno, sino que también es estable, -2.
Sólo después de estos pasos, es posible calcular el grado de oxidación del componente central de la fórmula. Como una muestra específica considerar elementos que determinan el grado de oxidación en ácido sulfúrico, H2SO4. Dado que en la molécula de la sustancia complejo contiene dos protones de hidrógeno, 4 átomos de oxígeno, se obtiene una expresión de la forma + 2 + X-8 = 0. Con el fin de suma formada cero, Y es el grado de oxidación del azufre 6
La alineación de la oxidación en las sales
Las sales son compuestos complejos que consisten en iones metálicos y uno o más aniones. Los métodos para determinar el grado de oxidación de cada uno de los componentes en la sal compleja es la misma que en los ácidos que contienen oxígeno. Dado que el grado de oxidación de los elementos – un indicador digital, es importante para indicar el grado de oxidación del metal.
Si el metal que forma la sal es en el subgrupo principal, su estado de oxidación es estable, correspondiente al número de grupo es positivo. Si la sal contiene un metal tal subgrupos PS exhibiendo diferentes valencias determinar la valencia del metal puede estar en el residuo de ácido. Cuando el grado de oxidación del metal para ser instalado, poner el grado de oxidación del oxígeno (-2), seguido por el cálculo del grado de oxidación del cuerpo central mediante el uso de la ecuación química.
Como ejemplo, considerar la definición de estados de oxidación de los elementos en el nitrato de sodio (sal normal). NaNO3. se forma Sol subgrupo principal del metal del grupo 1, por lo tanto, el grado de oxidación de sodio es 1. En oxígeno en estado de oxidación nitrato de -2. Para determinar el valor numérico de la oxidación equivale + 1 + X-6 = 0. Resolviendo esta ecuación, se obtiene que X debe ser 5, este es el grado de oxidación de nitrógeno.

Términos clave del IAD
Existen condiciones especiales que se requieren para aprender los estudiantes para el proceso de oxidación y reducción.
El grado de la oxidación es su capacidad para dirigir adjuntar a sí mismo (para dar diferentes) electrones de algunos de los iones o átomos.
El oxidante se considera átomos neutros o iones durante la reacción química en sí se une a los electrones.
El agente reductor se átomos no cargados o iones que, en el proceso de interacción química pierden sus propios electrones.
El procedimiento de oxidación se representa como impacto de electrones.
La recuperación se asocia con la adopción de electrones adicionales átomo sin carga o de iones.
proceso redox se caracteriza por la reacción, en el curso de la cual cambia necesariamente el grado de oxidación de un átomo. Esta definición nos permite comprender cómo es posible determinar si la reacción de la ISI.

reglas de análisis OVR
El uso de este algoritmo, los coeficientes pueden ser dispuestos en cualquier reacción química.
-
En primer lugar hay que colocar en cada estado de oxidación química. Tenga en cuenta que una sencilla cuestión estado de oxidación de cero, ya que no hay salida (conexión) de partículas negativas. Términos de colocación de la oxidación en compuestos binarios y de tres elementos fueron examinados por nosotros anteriormente.
-
Entonces es necesario identificar aquellos átomos o iones, que se han producido durante la conversión, la oxidación cambió.
-
Fecha de grabación desde el lado izquierdo de la ecuación es átomos o iones aislados, que han cambiado su grado de oxidación. Es necesario que el balance. A través de los elementos requeridos para indicar su valor.
-
Además escrito esos átomos o iones que se forman durante la reacción, un signo + indica el número de electrones átomo aceptado, – el número de partículas negativas del elenco. Si el proceso de interacción se reducen estado de oxidación. Esto significa que los electrones se tomaron átomo (ion). Cuando el grado de átomo de oxidación (ion) para donar electrones durante la reacción.
-
El número total más pequeño tomado para dividir la primera, a continuación, para emitir durante electrones coeficientes obtenidos. Los números de punto son los factores estereoquímicos requeridos.
-
Determinar oxidante, reductor, los procesos que se producen durante la reacción.
-
El paso final será la alineación de factores estereoquímicos en esta reacción.
ejemplo OVR
Consideremos una aplicación práctica del algoritmo en una reacción química en particular.
Fe + CuSO4 = Cu + FeSO4
Calculamos todas las sustancias simples y complejos.
Desde Fe y Cu son sustancias simples, su estado de oxidación es 0. En CuSO4, el Cu + 2, a continuación, 2 de oxígeno, azufre y al 6. En FeSO4: Fe 2, por lo tanto, para un O 2, calc S 6.
Ahora están buscando los elementos que podrían cambiar las cifras, en nuestra situación, van a ser de Fe y Cu.
Dado que el valor después de la reacción en el átomo de hierro fue de 2, 2 electrones se le dio en la reacción. Cobre cambiaron sus índices de 0 a 2, en consecuencia, el cobre llevó 2 electrones. Ahora se define el número de electrones recibidas y echado átomo de hierro y catión cúprico. Durante la conversión tomado catión mismo átomo de hierro de electrones dado dos electrones cúprico.
En este proceso no es relevante para determinar el mínimo común múltiplo, tomada y dada durante la conversión número igual de electrones. factores estereoquímicos también se ajustarán a uno. En la reacción del agente reductor exhibirá propiedades de hierro, mientras que se oxida. cobre catión divalente se reduce a cobre puro en la reacción que tiene el más alto grado de oxidación.

proceso de solicitud
Fórmula grado de oxidación debe ser conocido a todas las clases colegial 8-9, ya que este problema se incluye en el trabajo OGE. Todos los procesos que ocurren con el oxidante, lo que reduce los síntomas, juega un papel importante en nuestras vidas. Son procesos metabólicos indispensables en el cuerpo humano.