El agua amoniacal: obtener, fórmula aplicar
gas incoloro con un olor fuerte, el amoníaco NH 3 no sólo es fácilmente soluble en agua con desprendimiento de calor. Sustancia activa reacciona con las moléculas de H 2 O para formar un álcali débil. La solución ha recibido varios nombres, uno de ellos – agua amoniacal. El compuesto tiene propiedades sorprendentes, que están en el proceso de formación, la composición y reacciones químicas.
formación de iones de amonio
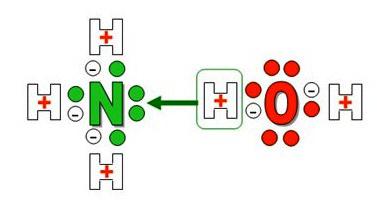 agua amoniacal Formula – NH 4 OH. La composición de materia está presente catión NH4 +, que se forma no metales – nitrógeno e hidrógeno. N átomos de la molécula de amoníaco se utiliza para formar enlaces covalentes de la polar sólo 3 de 5 de los electrones exteriores, y un par no ha sido reclamada. El fuertemente polarizado molécula de agua protones de hidrógeno H + fijado débilmente con el oxígeno, uno de ellos se convierte en un par de electrones solitario donante de nitrógeno (aceptor).
agua amoniacal Formula – NH 4 OH. La composición de materia está presente catión NH4 +, que se forma no metales – nitrógeno e hidrógeno. N átomos de la molécula de amoníaco se utiliza para formar enlaces covalentes de la polar sólo 3 de 5 de los electrones exteriores, y un par no ha sido reclamada. El fuertemente polarizado molécula de agua protones de hidrógeno H + fijado débilmente con el oxígeno, uno de ellos se convierte en un par de electrones solitario donante de nitrógeno (aceptor).
Formado un ion de amonio con una carga positiva y un tipo especial de enlace covalente débil – donante-aceptor. Por su tamaño, carga, y algunas otras características se asemeja a la de cationes de potasio y se comporta como un metal alcalino. Inusual en términos del compuesto químico reacciona con ácidos formando sales son de gran importancia práctica. Nombres, que reflejan las características y propiedades de la materia:
- agua amoniacal;
- hidróxido de amonio;
- hidrato de amoniaco;
- amoníaco cáustico.
medidas de precaución
Se debe tener cuidado cuando se trabaja con amoniaco y sus derivados. Es importante tener en cuenta:
- agua de amoníaco tiene un olor desagradable. El gas que se escapa irrita la superficie de la mucosa nasal del ojo, causando tos.
- Al almacenar amoniaco en un viales sin apretar cerrados, ampollas liberan amoníaco.
- Se puede detectar sin instrumentos, solamente por el olor incluso una pequeña cantidad de gas en solución y el aire.
- La relación entre las moléculas y cationes varía a pH diferente en la solución.
- Con un valor de aproximadamente 7 disminuye la concentración de gas tóxico NH 3 se incrementa cantidad menos nocivo para los organismos que viven cationes NH 4 +
Preparación de hidróxido de amonio. propiedades físicas
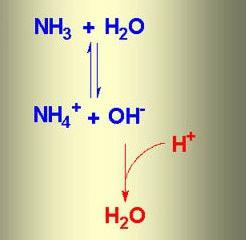
Cuando se disuelve en agua, el amoniaco formado agua amoniacal. Fórmula de la sustancia – NH 4 OH, pero de hecho ambos iones están presentes
NH 4 +, OH -, moléculas de NH 3 y H 2 O. La reacción de intercambio químico de iones entre el amoníaco y agua, un estado de equilibrio. El proceso puede ser reflejada por el circuito, en la que las flechas dirigidas en sentido opuesto indican la reversibilidad de los fenómenos.
En la preparación de laboratorio de agua amoniacal se lleva a cabo en experimentos con compuestos que contienen nitrógeno. Cuando se mezcla con agua de amoniaco para dar un líquido incoloro transparente. A altas presiones la solubilidad del gas aumenta. El agua ya envía disuelto en ella amoníaco a temperaturas más altas. Con fines industriales y la agricultura a escala industrial para dar sustancia 25 por ciento cuando se disuelve amoníaco. El segundo método utiliza la reacción de gas de horno de coque con agua.
Las propiedades químicas de hidróxido de amonio
Al comunicarse con los dos líquidos – agua de amoníaco y ácido clorhídrico – están cubiertas por los clubes de humo blanco. Se compone de partículas del producto de reacción – cloruro de amonio. Con una sustancia tan volátil tal como ácido clorhídrico, la reacción se lleva a cabo directamente en el aire.

Bajo contenido de álcalis propiedades químicas hidróxido de amonio:
- La sustancia se disocia de forma reversible en agua para formar un catión de amonio y un ion hidróxido.
- En presencia de NH 4 + ion, la fenolftaleína solución incolora teñido de color magenta como en álcalis.
- Química de neutralización con ácido resulta en la formación de sales de amonio y de agua: NH 4 OH + HCl = NH 4 Cl + H 2 O.
- agua amoniaco entra en la reacción de intercambio de iones con las sales metálicas, que corresponden a la base débil, formando de ese modo un hidróxido insoluble en agua: 2NH 4 OH + CuCl 2 = 2NH 4 Cl + Cu (OH) 2 (precipitado azul).
agua amoniacal: aplicación en diversos sectores de la economía
inusual sustancia es ampliamente utilizado en la vida cotidiana, la agricultura, la medicina y la industria. amoniaco hidrato técnicos utilizados en la agricultura, carbonato de sodio, colorantes y otros productos. En el fertilizante líquido contiene nitrógeno en las plantas fácilmente forma digerible. La sustancia se considera que es el más barato y más eficaz para la inclusión en el pre-periodo para todos los cultivos.

Para la producción de agua de amoníaco se consume tres veces menos fondos que en el tema de fertilizante de nitrógeno granular sólido. Para el almacenamiento y transporte de líquido aplicadas cisternas cerradas herméticamente son de acero. Algunos tipos de pinturas y herramientas para el decolorante de cabello producidos utilizando hidróxido de amonio. En cada uno de los preparados institución médica es con amoniaco – solución de amoniaco al 10 por ciento.
sales de amonio: propiedades y importancia práctica

Sustancias que se preparan por reacción de hidróxido de amonio con ácidos, se utilizan en actividades comerciales. Las sales se descomponen cuando se calientan, se disuelven en agua, se somete a hidrólisis. Entran en reacción química con álcalis y otras sustancias. El valor práctico más importante adquirió cloruros, nitratos, sulfatos, fosfatos, y carbonato de amonio.
Es importante seguir las normas y medidas de seguridad, trabajar con sustancias, que se compone de iones de amonio. Cuando se almacena en almacenes y empresas agrícolas comerciales, parques deben ser contacto de estos compuestos con álcalis y cal. Si los paquetes a prueba de fugas que se inician una reacción química con la liberación de gases tóxicos. Cualquier persona que tiene que trabajar con agua de amoníaco y sales de los mismos, debe conocer los fundamentos de la química. En cumplimiento de los requisitos de seguridad de los materiales utilizados no perjudicará a una persona o el medio ambiente.



















