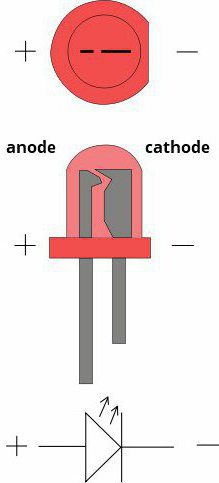
El ánodo y el cátodo – lo que es y cómo identificar?
Sobre el ánodo y el cátodo de la fuente de alimentación que necesita saber los que se dedican a la electrónica prácticos. ¿Qué y cómo se llama? ¿Por qué? Será el examen a fondo del tema desde el punto de vista no sólo de radioaficionados, sino también la química. La explicación más popular es el siguiente: ánodo – un electrodo positivo y el cátodo – negativo. Por desgracia, esto no siempre es cierto e incompleta. Para poder definir el ánodo y el cátodo, es necesario contar con una base teórica y saber que como un sí. Vamos a examinar este artículo.
ánodo
 Haciendo referencia a GOST 15596-82, que se dedica a químicos fuentes de corriente. Estamos interesados en la información colocada en la tercera página. De acuerdo con GOST, el electrodo negativo de la celda electroquímica es exactamente el ánodo. Eso es así, sí! Y por qué? El hecho es que a través de él la corriente eléctrica que proviene del circuito externo a la propia fuente. Como se puede ver, no es tan fácil como parece a primera vista. Puede ser aconsejable considerar cuidadosamente la imagen presentada en el artículo, si el contenido parece demasiado complicado – que le ayudará a entender lo que el autor quiere transmitir a usted.
Haciendo referencia a GOST 15596-82, que se dedica a químicos fuentes de corriente. Estamos interesados en la información colocada en la tercera página. De acuerdo con GOST, el electrodo negativo de la celda electroquímica es exactamente el ánodo. Eso es así, sí! Y por qué? El hecho es que a través de él la corriente eléctrica que proviene del circuito externo a la propia fuente. Como se puede ver, no es tan fácil como parece a primera vista. Puede ser aconsejable considerar cuidadosamente la imagen presentada en el artículo, si el contenido parece demasiado complicado – que le ayudará a entender lo que el autor quiere transmitir a usted.
cátodo
Nos dirigimos a todos a la misma GOST 15596-82. El electrodo positivo de la célula electroquímica es que, en la descarga de la que sale en el circuito externo. Como se puede ver, los datos contenidos en la norma IEC 15596-82, ver la situación desde una posición diferente. Por lo tanto, en consulta con otros sobre ciertas estructuras tienen que ser muy cuidadosos.
La aparición de términos
 Se presentaron más de Faraday en enero de 1834, para evitar confusiones y para lograr una mayor precisión. Él ofreció su propia versión, y recordando el ejemplo del sol. Por lo tanto, tiene un ánodo – va en aumento. Sol se mueve hacia arriba (corriente entra). Cátodo – se establece. El sol se pone (actual).
Se presentaron más de Faraday en enero de 1834, para evitar confusiones y para lograr una mayor precisión. Él ofreció su propia versión, y recordando el ejemplo del sol. Por lo tanto, tiene un ánodo – va en aumento. Sol se mueve hacia arriba (corriente entra). Cátodo – se establece. El sol se pone (actual).
tubos de radio Ejemplo y diodo
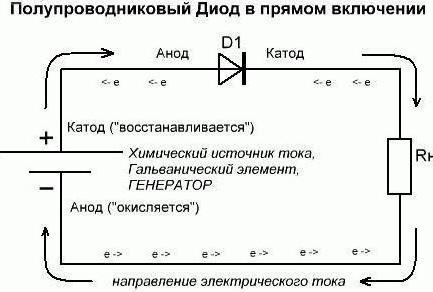
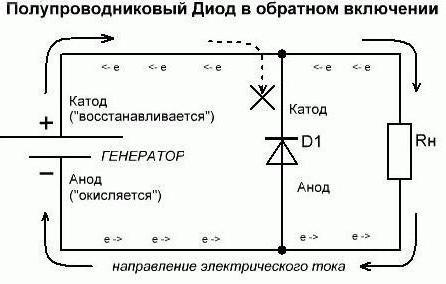 Seguimos a entender que se refieren a lo que se utiliza. Supongamos que uno del poder que tenemos estos consumidores en un estado abierto (en vivo). Así, desde el circuito externo por un diodo el elemento de ánodo es la corriente eléctrica. Pero no confundir a causa de esta explicación de la dirección del electrón. A través del cátodo en un circuito externo de las salidas de elementos de corriente eléctrica utilizada. Una situación que se ha desarrollado hoy en día, recuerda casos cuando la gente mira el patrón invertido. Si los datos se refieren al complejo – recuerda que para entender ellos de esta manera necesariamente de forma exclusiva a los químicos. Y ahora vamos a hacer la inclusión inversa. Cabe señalar que los diodos semiconductores prácticamente no van a conducir corriente. La única excepción posible aquí – los elementos de ruptura inversa. Un diodo de vacío (Kenotrón, radio) generalmente no conducirá corriente inversa. Por lo tanto, considera (arbitrariamente) que no pasa por ellos. Por lo tanto, las conclusiones formales en el ánodo y el cátodo del diodo no realizan sus funciones.
Seguimos a entender que se refieren a lo que se utiliza. Supongamos que uno del poder que tenemos estos consumidores en un estado abierto (en vivo). Así, desde el circuito externo por un diodo el elemento de ánodo es la corriente eléctrica. Pero no confundir a causa de esta explicación de la dirección del electrón. A través del cátodo en un circuito externo de las salidas de elementos de corriente eléctrica utilizada. Una situación que se ha desarrollado hoy en día, recuerda casos cuando la gente mira el patrón invertido. Si los datos se refieren al complejo – recuerda que para entender ellos de esta manera necesariamente de forma exclusiva a los químicos. Y ahora vamos a hacer la inclusión inversa. Cabe señalar que los diodos semiconductores prácticamente no van a conducir corriente. La única excepción posible aquí – los elementos de ruptura inversa. Un diodo de vacío (Kenotrón, radio) generalmente no conducirá corriente inversa. Por lo tanto, considera (arbitrariamente) que no pasa por ellos. Por lo tanto, las conclusiones formales en el ánodo y el cátodo del diodo no realizan sus funciones.
¿Por qué hay confusión?
En concreto, con el fin de facilitar el aprendizaje y la aplicación práctica, se decidió que los elementos de nombre de los terminales del diodo no cambiarán independientemente de su tipo de conexión, y que se "une" a los hallazgos físicos. Pero esto no se aplica a las baterías. Así, en los diodos semiconductores todo depende del tipo de conductividad del cristal. Los tubos de vacío que cuestionan está unido a un electrodo que emite electrones en lugar de la disposición de filamentos. Por supuesto, aquí hay algunos matices: por ejemplo, a través de tales dispositivos semiconductores, como un supresor y un diodo zener pueden ser un poco flujo de corriente inversa, pero aquí hay detalles, claramente más allá del alcance de este artículo.
Investigado con acumulador eléctrico
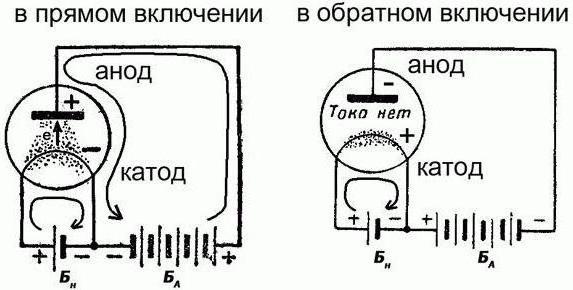 Este es realmente un ejemplo clásico de una fuente química de la corriente eléctrica, que es renovable. La batería está en uno de dos modos: la carga / descarga. En ambos casos será diferente dirección de la corriente eléctrica. Pero tenga en cuenta que la polaridad de los electrodos al mismo tiempo no va a cambiar. Y pueden actuar en diferentes roles:
Este es realmente un ejemplo clásico de una fuente química de la corriente eléctrica, que es renovable. La batería está en uno de dos modos: la carga / descarga. En ambos casos será diferente dirección de la corriente eléctrica. Pero tenga en cuenta que la polaridad de los electrodos al mismo tiempo no va a cambiar. Y pueden actuar en diferentes roles:
- Durante la carga, el electrodo positivo acepta la corriente eléctrica y un ánodo, y su negativa y libera la llamada cátodo.
- En la ausencia de movimiento en ellos para llevar a cabo una conversación no tiene sentido.
- Durante la descarga, el electrodo positivo libera una corriente eléctrica y un cátodo, y el negativo recibe y se llama el ánodo.
En Electroquímica dicen una palabra
Se utiliza una definición ligeramente diferente. Por lo tanto, el ánodo se considera como un electrodo donde se producen procesos de oxidación. Y la escuela de recuerdo de la química, que puede responder a lo que está pasando en el otro lado? El electrodo en el que los procesos que se recuperan, llamado el cátodo. Sin embargo, no se hace referencia a los dispositivos electrónicos. Veamos el valor de las reacciones de oxidación-reducción a nosotros:
- La oxidación. Hay un proceso de retorno de una partícula de electrones. Neutral se convierte en un ion positivo, y se neutraliza la negativa.
- La recuperación. El proceso de obtener una partícula de electrones. Positivo transforma en un ion neutral, y luego a negativo en la iteración.
- Los dos procesos son interdependientes (por ejemplo, el número de electrones que dan es igual ADJOINT su número).
Faraday también para indicar los nombres se han introducido para los elementos que toman parte en las reacciones químicas:
- Cationes. La llamada cargados positivamente iones que se mueven en la solución de electrolito en el polo negativo (cátodo).
- Aniones. Así que llamaron los iones negativos que se están moviendo en la solución electrolítica en el polo positivo (ánodo).
¿Cómo se producen reacciones químicas?
 Oxidación y reducción semirreacciones están separados en el espacio. La transición de electrones entre el cátodo y el ánodo se lleva a cabo no directamente, sino a través de un conductor del circuito externo, lo que crea una corriente eléctrica. Aquí se puede observar la interconversión de formas químicas y eléctricas de energía. Por lo tanto, para formar un sistema de circuito externo de los conductores de varios tipos (que es lo que los electrodos en el electrolito), y es necesario el uso de metal. Véase, la tensión entre el ánodo y el cátodo existe como una advertencia. Y si no existía ningún elemento que les impide directamente para hacer el proceso necesario, el valor de las fuentes de corriente químicas sería muy baja. Y así, gracias al hecho de que la carga es necesario caminar sobre el esquema, recogidos y trabajó como técnico.
Oxidación y reducción semirreacciones están separados en el espacio. La transición de electrones entre el cátodo y el ánodo se lleva a cabo no directamente, sino a través de un conductor del circuito externo, lo que crea una corriente eléctrica. Aquí se puede observar la interconversión de formas químicas y eléctricas de energía. Por lo tanto, para formar un sistema de circuito externo de los conductores de varios tipos (que es lo que los electrodos en el electrolito), y es necesario el uso de metal. Véase, la tensión entre el ánodo y el cátodo existe como una advertencia. Y si no existía ningún elemento que les impide directamente para hacer el proceso necesario, el valor de las fuentes de corriente químicas sería muy baja. Y así, gracias al hecho de que la carga es necesario caminar sobre el esquema, recogidos y trabajó como técnico.
Lo que es: Paso 1
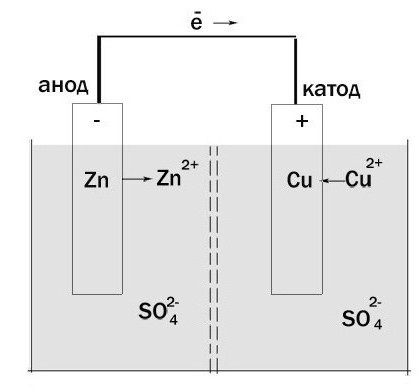 Ahora vamos a determinar cuál es cuál. Tome una célula galvánica-Jacobi Daniel. Por un lado se compone del electrodo de zinc, que se sumerge en una solución de sulfato de zinc. Entonces hay una barrera porosa. Y en el otro lado tiene un electrodo de cobre, que está dispuesto en una solución de sulfato de cobre. Ellos están en contacto entre sí, pero las características químicas y el tabique no dan mezclan.
Ahora vamos a determinar cuál es cuál. Tome una célula galvánica-Jacobi Daniel. Por un lado se compone del electrodo de zinc, que se sumerge en una solución de sulfato de zinc. Entonces hay una barrera porosa. Y en el otro lado tiene un electrodo de cobre, que está dispuesto en una solución de sulfato de cobre. Ellos están en contacto entre sí, pero las características químicas y el tabique no dan mezclan.
Paso 2: Proceso
oxidación de zinc se produce y los electrones se mueven a través de un circuito externo al cobre. Así resulta que la celda electroquímica tiene un ánodo, con carga negativa, y el cátodo – lo positivo. Por otra parte, este proceso puede tener lugar sólo en los casos en que los electrones es donde "ir". El hecho es que para llegar directamente desde el electrodo a otro impide la existencia de "aislamiento".
Paso 3: La electrólisis
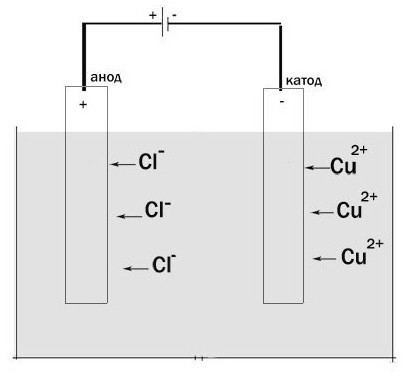 Veamos el proceso de electrólisis. Instalación para su paso es un recipiente en el que hay una solución de electrolito o fundir. El electrodo tiene dos omitido. Están conectados a una fuente de alimentación de CC. El ánodo en este caso – es el electrodo conectado al polo positivo. Aquí se oxida. Un electrodo cargado negativamente – el cátodo es. Aquí, una reacción de reducción se lleva a cabo.
Veamos el proceso de electrólisis. Instalación para su paso es un recipiente en el que hay una solución de electrolito o fundir. El electrodo tiene dos omitido. Están conectados a una fuente de alimentación de CC. El ánodo en este caso – es el electrodo conectado al polo positivo. Aquí se oxida. Un electrodo cargado negativamente – el cátodo es. Aquí, una reacción de reducción se lleva a cabo.
Paso 4: Finalmente
Por lo tanto, cuando se opera estos conceptos siempre hay que tener en cuenta que el ánodo no está en el 100% de los casos se utilizan para denotar un electrodo negativo. Además, el cátodo puede perder su carga positiva intermitente. Todo depende de lo que se lleva a cabo tipo de proceso en el electrodo: un oxidante o reductor.
conclusión
Eso es todo esto es – no es muy difícil, pero no se puede decir así de simple. Hemos considerado una celda galvánica, el ánodo y el cátodo en términos del esquema, y ahora los problemas con la conexión con el tiempo de funcionamiento de la fuente de alimentación que no debería ser. Y, por último, es necesario dejar un poco más valioso para usted información. Siempre tenga en cuenta la diferencia, que tiene el potencial del cátodo / el potencial del ánodo. El hecho de que la primera siempre será un poco grande. Esto es debido al hecho de que la eficiencia no funciona con la figura de 100% y una porción de la carga se disipa. Es debido a esto se puede ver que las baterías tienen un límite en el número de tiempos de carga y descarga.

















