Determinado por la valencia de los elementos químicos
El conocimiento de la estructura de los átomos y moléculas en el siglo XIX no puede explicar la razón por la cual un cierto número de átomos de formar enlaces con otras partículas. Pero las ideas de los científicos por delante de su tiempo, y la valencia del todavía están estudiando como uno de los principios básicos de la química.
De la historia del concepto de "valencia de los elementos químicos"
Sobresaliente británico del siglo XIX químico Edvard Franklend acuñó el término "comunicación" en el uso científico para describir la interacción de los átomos entre sí. Scientific notó que algunos elementos químicos forman compuestos con la misma cantidad de otros átomos. Por ejemplo, el nitrógeno se une tres átomos de hidrógeno en una molécula de amoníaco.
En mayo de 1,852 mil Frankland planteó la hipótesis de que existe un número específico de enlaces químicos que un átomo puede formar con otras pequeñas partículas de materia. Frankland usó la frase "la fuerza de conexión" para describir lo que luego se llamó valencia. químico británico establecido como los enlaces químicos formar átomos de los elementos individuales conocidos en la mitad del siglo XIX. Frankland trabajo fue una contribución importante a la química estructural moderna.

el desarrollo de puntos de vista
químico alemán FA Kekulé demostró en 1857 que el carbono es chetyrehosnovnym. En su forma más simple compuesto – metano – surgir debido a 4 átomos de hidrógeno. El término científico "basicidad" utiliza para designar elementos propiedades conectan un número fijo de otras partículas. En Rusia, los datos sobre la estructura de la materia sistematizado A. M. Butlerov (1861). El desarrollo adicional de la teoría del enlace químico obtenido a través de las enseñanzas de la cambio periódico en las propiedades de los elementos. Su autor – otra destacada químico ruso D. I. Mendeleiev. Se demostró que la valencia de los elementos químicos en los compuestos, y otras propiedades se determinan por la posición que ocupan en el sistema periódico.
 Representación gráfica de la valencia y la química de unión
Representación gráfica de la valencia y la química de unión
La posibilidad de moléculas de visualización de – uno de los méritos indudables de la teoría de valencia. El primer modelo apareció en 1860, y desde 1864 ha estado utilizando fórmulas estructurales que representan marca circunferencial química dentro. Entre símbolos átomos de trazos denotan enlace químico, y el número de líneas es igual a la valencia. En esos mismos años, se hizo el primer modelo sharosterzhnevye (ver. Foto de la izquierda). En 1866, Kekulé propuso patrón estereoquímica de los átomos de carbono en la forma de un tetraedro, que incluyó en su libro de texto "Química Orgánica".
Valencia de los elementos químicos, y la aparición de las relaciones estudiadas por G. Lewis, que publicó sus obras en 1923 después del descubrimiento del electrón. La llamada carga negativa partículas diminutas, que son parte de los proyectiles atómicos. En su libro, Lewis utilizó un punto alrededor de los cuatro lados del símbolo químico para la visualización de los electrones de valencia.
Valencia de hidrógeno y oxígeno
Antes de la creación de la tabla periódica de valencia de los elementos químicos en los compuestos se realizó para comparar con los átomos a los que se le conoce. El hidrógeno y el oxígeno se seleccionaron como referencia. Otro elemento químico es atraído o bien sustituido por un cierto número de átomos de H, y O.
De esta manera, las propiedades se determinaron en un compuestos monovalentes con hidrógeno (la valencia del segundo elemento es designado por el número romano):
- HCl – cloro (I):
- H 2 O – oxígeno (II);
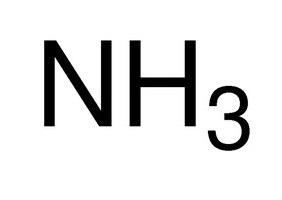
- NH 3 – nitrógeno (III);
- CH 4 – carbono (IV).
Los óxidos de K 2 O, CO, N 2 O 3, SiO 2, SO 3 se determinaron mediante la valencia de metales y no metales oxígeno, duplicando el número de átomos de acoplable O. Obtenido siguientes valores: K (I), C ( II), N (III) , Si (IV), S (VI).
Cómo determinar la valencia de los elementos químicos
Hay leyes de la formación de enlaces químicos con los pares de electrones comunes:
- Típica de valencia de hidrógeno – I.
- valencia normal de oxígeno – II.
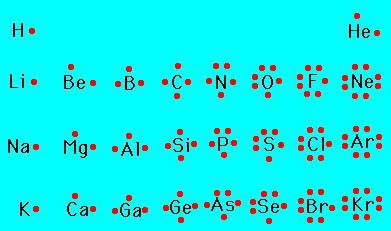
- Para los elementos no metales-inferior de valencia se pueden determinar por la fórmula 8 – № grupo en el que están en el sistema periódico. Más alto, si puede ser determinado por el número de grupo.
- Para los elementos secundarios de subgrupos valencia máxima posible es el mismo que el número de grupos de la tabla periódica.
Determinación de la valencia de los elementos químicos de compuesto de fórmula se lleva a cabo utilizando el siguiente algoritmo:
- Grabar en la parte superior del valor conocido químicamente familiar para uno de los elementos. Por ejemplo, en Mn 2 O 7 valencia oxígeno es II.
- Calcular el valor total, que debe ser multiplicado por la valencia del número de átomos del mismo elemento químico en la molécula, 2 * 7 = 14.
- Determinar la valencia del segundo elemento, para lo cual es desconocido. Divide obtiene en la Sec. 2 valor por el número de átomos de Mn en la molécula.
- 14: 2 = 7. La valencia del óxido de manganeso en su más alta – VII.
valencia permanentes y variables
valores de valencia de hidrógeno y oxígeno son diferentes. Por ejemplo, el azufre en el compuesto de H 2 S es divalente, que en la fórmula SO 3 – hexavalente. El monóxido de carbono reacciona con el oxígeno, CO y dióxido de CO 2. El primer compuesto es la valencia de C II, y en el segundo – IV. El mismo valor en CH metano 4.
La mayoría de los elementos no presentan valencia constante y variable, por ejemplo, fósforo, nitrógeno, azufre. La búsqueda de las principales causas de este fenómeno condujo a una teoría de la unión química, los conceptos de electrones de la capa de valencia, orbitales moleculares. La existencia de diferentes valores de las mismas propiedades obtenidas con la explicación de la estructura de los átomos y las moléculas de posición.
La concepción moderna de valencia
Todos los átomos están compuestos de núcleo positivo rodeado de electrones cargados negativamente. La capa exterior, que se forman, está sin terminar. La estructura completa es la más estable, que contiene 8 electrones (octeto). Enlace químico con los pares de electrones resultados comunes en la Condición átomos energéticamente favorable.
Regla para la formación de compuestos es la realización de una concha o mediante la recepción de electrones retroceden desapareado – dependiendo de si el proceso es más fácil de pasar. Si átomo prevé la formación de un partículas negativas enlace químico que no tienen par, los enlaces que forma con tal de que electrones desapareados. De acuerdo con los conceptos modernos, la valencia de los átomos de los elementos químicos – es la capacidad para producir un cierto número de enlaces covalentes. Por ejemplo, en la molécula, H 2 S de azufre, sulfuro de hidrógeno adquiere valencia II de (-), porque cada átomo participa en la formación de dos pares de electrones. El signo "-" indica la atracción del par de electrones al elemento más electronegativo. Al menos electronegativo que el valor de la valencia anexa "+".
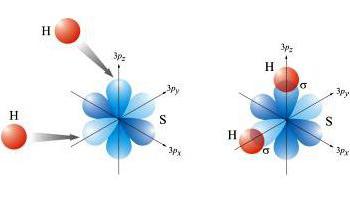
Cuando mecanismo donador-aceptor están involucrados en el proceso de pares de electrones de uno de los elementos y los otros orbitales de valencia libres.
La dependencia de la valencia de la estructura del átomo
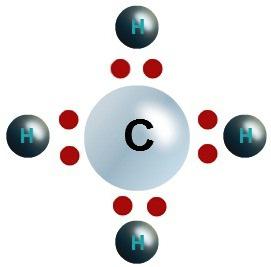
Considere, por ejemplo, carbono y oxígeno, ya que depende de la estructura de las sustancias de valencia de los elementos químicos. Tabla Periódica da una visión general de las características básicas del átomo de carbono:
- símbolo químico – C;
- número de artículo – 6;
- carga nuclear – 6;
- protones en el núcleo – 6;
- electrón – 6, incluyendo 4 externo, 2 de los cuales forman un par, 2 – desapareado.
Si el átomo de carbono forma dos enlaces en monoookside CO, entonces su uso se suministra sólo 6 partículas negativas. Para adquirir octetos necesarios para emparejar 4 partículas negativas externos formados. El carbono tiene una valencia de IV (+) en dióxido y IV (-) en metano.
número ordinal de oxígeno – 8, la capa de valencia consta de seis electrones, dos de ellos forman un par y están implicadas en los enlaces químicos y la interacción con otros átomos. valencia Típica oxígeno – II de (-).

El estado de valencia y la oxidación
En muchos casos es más conveniente utilizar el término "grado de oxidación". Llamado átomo de carga que adquiriría si todos los electrones se han trasladado al elemento de unión, que tiene una elektroootritsatelnosti de mayor valor (OE). El número de oxidación de la sustancia simple es cero. Por oxidación más EO elemento añadido signo "-", menos electronegativo – "+". Por ejemplo, los principales metales del grupo para la oxidación típico y ion cargas iguales número con el signo de la "+". En la mayoría de los casos la valencia y la oxidación de estado de los átomos en el mismo compuesto numéricamente coinciden. Sólo cuando la interacción con átomos electronegativos más del estado de oxidación positivo, con elementos cuya EO abajo – negativas. El concepto de "valencia de" a menudo se aplica sólo a la sustancia de la estructura molecular.


















