Helium: propiedades, características, la aplicación
El helio – gas inerte del grupo 18 de la tabla periódica. Este es el segundo elemento más ligero después de hidrógeno. El helio – gas sin color, olor y sabor que se convierte en líquido a una temperatura de -268,9 ° C. punto de ebullición y su punto de congelación más bajo que el de cualquier otra sustancia conocida. Es el único elemento que no se solidifica con el enfriamiento a presión atmosférica normal. Se trasladó al estado sólido debe ser de 25 atmósferas, a una temperatura de 1 K.
Historia del descubrimiento
El helio se encuentra en la atmósfera gas que rodea el sol, el astrónomo francés Pierre Zhansenom que en 1868 durante un eclipse ha encontrado una línea de color amarillo brillante en el espectro de la cromosfera solar. Inicialmente se supone que esta línea representa el elemento de sodio. En el mismo año, Inglés astrónomo Dzhozef Norman Lockyer observó una línea amarilla en el espectro solar, que no corresponde a las líneas de sodio conocidos D 1 y D 2, y por lo tanto se llama una línea D 3. Lockyer concluyó que fue causada por una sustancia desconocida en el Sol en la Tierra. Él y el químico Edward Frankland en el elemento de título utilizando el nombre griego 'Helios' Sun.
En 1895, el químico británico Uilyam Ramzay ha demostrado la existencia de helio en la Tierra. Recibió minerales de uranio-cojinete cleveite de muestra, y después de examinar los gases formados durante el calentamiento, se encuentra que brillante línea amarilla en el espectro coincide con la línea D 3, observado en el espectro solar. Por lo tanto, un nuevo elemento fue finalmente instalado. En 1903 Ramsay y Frederick Soddy encontraron que el helio es un producto de la descomposición espontánea de sustancias radiactivas.

Distribución en la naturaleza
La masa del helio es aproximadamente el 23% de la masa total del universo, y el elemento es la segunda más común en el espacio. Se concentra en estrellas, donde se forma hidrógeno a partir de la fusión resultante. Aunque el helio en la atmósfera es en una concentración de 1 parte a 200 º. (5 ppm) y está contenida en pequeñas cantidades de minerales radiactivos, glándula meteoritos, así como fuentes de minerales, grandes cantidades del elemento que se encuentra en los Estados Unidos (especialmente en Texas, New Ciudad de México, Kansas, Oklahoma, Utah y Arizona) como componente (al 7,6%) de gas natural. Pequeño y sus reservas se han descubierto en Australia, Argelia, Polonia, Qatar y Rusia. En la concentración de corteza helio es sólo alrededor de 8 ppb.
isótopos
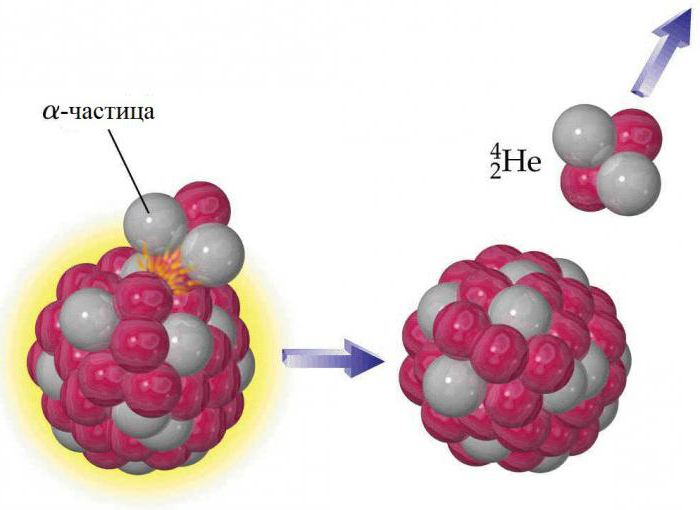
El núcleo de cada uno de los átomo de helio contiene dos protones, pero, como con otros elementos, tiene isótopos. Ellos contienen de uno a seis neutrones, por lo que sus números de masa de entre tres y ocho. Estable de estos son los elementos cuyo peso se determina por helio número atómico 3 (3 He) y 4 (4 He). Todos los demás radiactivos y rápidamente decaer en otras sustancias. helio de la Tierra no es una parte original del planeta, que se formó como resultado de la desintegración radiactiva. Las partículas alfa emitidas por núcleos de sustancias radioactivas son pesados isótopo 4 núcleo de He. El helio no se acumula en grandes cantidades en la atmósfera, debido a la gravedad de la Tierra no es suficiente para evitar que se escape progresivamente en el espacio. Las huellas de 3 Él en el mundo se explican hidrógeno beta decaimiento negativo rara 3-elemento (tritio). 4 Él es el más común de los isótopos estables: relación de 4 de átomos de He hacia el 3 Él es alrededor de 700 mil a 1 atmósfera y aproximadamente 7 millones por 1 en algunos minerales de helio-rico ..
Las propiedades físicas del helio
ebullición y punto de fusión de este artículo es más bajo. Por esta razón, existe el helio como gas, excepto en condiciones extremas. Él gas se disuelve en agua menor que la de cualquier otro gas, y la tasa de difusión a través del cuerpo sólido es tres veces mayor que la del aire. Su índice de refracción de los más cercanos se aproxima a 1.
La conductividad térmica del helio es la segunda a la conductividad térmica de hidrógeno, el calor específico y su extraordinariamente alta. A temperaturas ordinarias se calienta durante la expansión, y por debajo de 40 K – enfría. Por lo tanto, a T <40 K helio se puede convertir en un líquido mediante la expansión.
Elemento es un aislante, si no está en el estado ionizado. Al igual que con otros gases nobles, el helio tiene una metaestables niveles de energía que le permiten ser ionizado por una descarga eléctrica cuando un voltaje está por debajo del potencial de ionización.
Helio-4 es único en que tiene dos formas líquidas. existe Usual llamado helio I y a temperaturas que varían desde el punto de 4,21 K de ebullición (-268,9 ° C) hasta aproximadamente 2,18 K (-271 ° C). Baja conductividad térmica de 2,18 K 4 Se convierte en 1000 veces mayor que la del cobre. Esta forma se llama el helio II, para distinguirlo de lo común. Se ha superfluido: viscosidad es tan baja que no se puede medir. El helio II se extiende en una película fina en la superficie de cualquier sustancia que se refiere, y esta película está fluyendo sin fricción incluso en contra de la gravedad.
Menos abundante helio-3 forma tres fases líquidas diferentes, dos de los cuales son superfluido. La superfluidez en 4 Fue descubierto por el físico soviético Petrom Leonidovichem Kapitsey a mediados de la década de 1930, y el mismo fenómeno en el 3 Él se dio cuenta por primera vez por Douglas D. Osheroff, David M. Lee y Robert C. Richardson de los Estados Unidos en 1972.
Una mezcla líquida de dos isótopos de helio-3 y -4 a temperaturas inferiores a 0,8 K (-272,4 ° C) se divide en dos capas – una esencialmente puros 3 Él y 4 mezcla Él con 6% de helio-3. Disolución de 3 Él en 4 Está acompañado por el efecto de enfriamiento que se utiliza en estructuras de criostato en el que la temperatura del helio está por debajo de 0,01 K (-273,14 ° C) y se mantuvo durante unos pocos días.

conexiones
En condiciones normales, el helio es químicamente inerte. En extrema puede crear un elemento compuesto que en los indicadores normales de temperatura y presión no son estables. Por ejemplo, el helio puede formar compuestos con yodo, tungsteno, flúor, fósforo y azufre, cuando se somete a una descarga luminosa eléctrica o por bombardeo de electrones en el estado de plasma. Por lo tanto, se ha creado HeNe, HgHe 10, WHE 2 y los iones moleculares Él 2 + 2 No ++, je + y HED +. Esta técnica también ha sido una molécula neutra Él 2 y HgHe.
plasma
En el universo distribuido ventajosamente helio ionizado, cuyas propiedades difieren sustancialmente de la molecular. Los electrones y protones no estaba vinculado, y tiene una conductividad eléctrica muy alta incluso en un estado parcialmente ionizado. En partículas cargadas está muy influenciada por los campos magnéticos y eléctricos. Por ejemplo, en el viento solar con iones de helio interactuar con el ionizado tierra magnetosfera hidrógeno, causando la aurora boreal.

El descubrimiento de los depósitos en los EE.UU.
Después de perforar en 1.903 en Dexter, Kansas, que se obtuvo por gas no inflamable. Inicialmente, no se sabía que contiene helio. ¿Qué gas se encontró, estado identificado Erasmus Haworth geólogo, que ha recogido sus muestras y la Universidad de Kansas a través de los químicos KEDI Gamiltona y David McFarland encontró que contiene 72% de nitrógeno, 15% de metano, 1% de hidrógeno y no se identificó el 12%. Después de pasar el análisis posterior, los investigadores encontraron que 1,84% de la muestra de helio. Así que sabemos que este elemento químico está presente en grandes cantidades en las profundidades de las Grandes Llanuras, donde se puede extraer a partir de gas natural.
producción industrial
Esto ha hecho de Estados Unidos la producción mundial del líder de helio. A sugerencia de Sir Richard Threlfall, la Marina de los Estados Unidos financió tres pequeña planta piloto para producir esta sustancia durante la Primera Guerra Mundial para asegurar los globos de barrera de gas de levantamiento de peso ligero no inflamable. De acuerdo con este programa se produjeron en total de 5,700 m 3 92 por ciento Él, aunque esto sólo se obtuvo al menos 100 litros de gas. Una parte de esta cantidad se utilizó en primer dirigible de helio del mundo de la Marina de los EE.UU. C-7, que hizo su viaje inaugural desde Hampton Roads (Virginia) en el campo de Bolling (Washington, DC) 7 de diciembre de, 1921.
Aunque el proceso de gas licuado a baja temperatura en ese momento no estaba suficientemente desarrollada como para ser significativo durante la Primera Guerra Mundial, la producción continuó. El helio se utiliza generalmente como un gas de elevación en los aviones. La demanda de que se ha incrementado durante la Segunda Guerra Mundial, cuando se utiliza con una soldadura de arco protegido. El elemento también tiene gran importancia en la creación de la bomba atómica "Manhattan".

Reserva Nacional de EE.UU.
En 1925, el gobierno de Estados Unidos creó la reserva Nacional de helio en Amarillo, Texas, para proporcionar aeronaves militares en tiempo de guerra y aeronaves comerciales en tiempos de paz. El uso de gas cayó después de la Segunda Mundial, pero la población se incrementó en 1950 para proporcionar, entre otras cosas, se suministra como refrigerante utilizado en la producción de propulsantes de oxígeno-hidrógeno durante la carrera espacial y la Guerra Fría. El uso de helio en los Estados Unidos en 1965, ocho veces más alto que el pico de consumo en tiempos de guerra.
Después de la aprobación de la ley de 1960 de helio de Minería Streak 5 empresas privadas para extraer el elemento a partir del gas natural. Este programa fue construido 425 kilómetros de tuberías para conectar estas plantas con el campo de gas gobierno parcialmente agotado cerca de Amarillo, Texas. mezcla de helio y de nitrógeno bombea en el almacenamiento subterráneo, y permaneció allí hasta que no hay necesidad en ella.
En 1995, el volumen de acciones se monta mil millones de metros cúbicos, mientras que la deuda de la reserva nacional de 1,4 mil millones de dólares, lo que llevó al Congreso de Estados Unidos en 1996 para eliminar de ella. Tras la aprobación en 1996 de la ley sobre la privatización de helio Ministerio de Recursos Naturales puso en marcha una tienda de liquidación en 2005.

Limpia y producción
El helio producido hasta 1.945 años tenía una pureza de aproximadamente 98%, otros 2% estaban en el nitrógeno que es suficiente para aeronaves. En 1945, se produjo una pequeña cantidad de 99.9 por ciento de gas para su uso en soldadura por arco. Por 1949, la pureza del elemento ha alcanzado 99,995%.
Durante muchos años los Estados Unidos produce más del 90% de helio comercial del mundo. Desde 2004, cada año se ideó de 140 millones de m 3, el 85% de los cuales se producen en los Estados Unidos, el 10% se llevó a cabo en Argelia, y el resto – en Rusia y Polonia. Las principales fuentes de helio en el mundo son yacimientos de gas natural de Texas, Oklahoma y Kansas.
El proceso para obtener
El helio (pureza 98,2%) se recupera de la licuefacción de gas natural por otros componentes a bajas temperaturas y a altas presiones. La adsorción de otros gases enfriados carbón activado puede lograr la pureza de 99,995%. Una pequeña cantidad de helio produce durante la licuefacción de aire a gran escala. De las 900 toneladas de aire puede obtener alrededor de 3,17 metros cúbicos. m gas.

Los campos de aplicación
gas noble se ha aplicado en diversos campos.
- El helio, que propiedades permiten obtener muy baja temperatura, se utiliza como un agente de enfriamiento en LHC, MRI aparatos imán superconductor y espectrómetros de resonancia magnética nuclear, equipo de satélite, así como para la licuefacción de oxígeno e hidrógeno en misiles "Apollo".
- A medida que el gas inerte para la soldadura de aluminio y otros. Los metales en la fabricación de semiconductores y fibras ópticas.
- .. Para crear presión en los tanques de combustible de motores de cohetes, en particular los que operan en el hidrógeno líquido, t a sólo el gas helio conserva su estado de agregación cuando el hidrógeno permanece en estado líquido);
- He-Ne láseres de gas se utilizan para escanear el código de barras en la taquilla en los supermercados.
- microscopio de helio-ion le permite obtener la mejor imagen de lo electrónico.
- Debido a la alta permeabilidad del gas noble se utiliza para probar las fugas, por ejemplo en sistemas de aire acondicionado de automóviles, así como el llenado rápido de la bolsa de aire tras la colisión.
- Baja densidad permite que las bolas decorativas llenos de helio. El gas inerte se sustituye gas de hidrógeno explosivo en dirigibles y globos. Por ejemplo, en meteorología, globos de helio se utilizan para levantar el instrumento de medición.
- Se utiliza el refrigerante criogénico, ya que la temperatura del elemento químico en estado líquido mínimo posible.
- El helio, que propiedades le confieren una baja reactividad y solubilidad en agua (y sangre), en una mezcla con el oxígeno ha encontrado aplicación en formulaciones respiratorias para el buceo y la celebración de trabajo cajón.
- Meteoritos y rocas se analizan para determinar el contenido de este elemento para determinar su edad.
Helium: las propiedades del elemento
Él principales propiedades físicas son las siguientes:
- Número atómico: 2.
- La masa relativa del átomo de helio: 4,0026.
- Punto de fusión: no.
- Punto de ebullición: -268,9 ° C.
- Densidad (1 atm, 0 ° C): 0,1785 g / n.
- estado de oxidación 0.