El amoníaco – es la antípoda y analógica … agua?
El olor a gas se conoce a todo el mundo – se puede sentir inmediatamente cuando se abre un frasco con amoníaco. Algo sobre sus propiedades, nos dijeron en la escuela. También se conoce, sin embargo, que es uno de los principales productos de la industria química: a saber, que es más fácil de convertir el nitrógeno, lo que no le gusta a entrar en reacciones químicas. Amoníaco – este es el primer punto de partida para comenzar la producción de muchos compuestos de nitrógeno: varios nitritos y nitratos, explosivos y colorantes de anilina, productos farmacéuticos y plásticos …
fondo
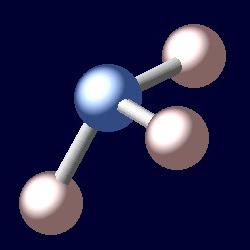 El nombre de la sustancia derivada de los «Hals ammoniakos» griegas, que se traduce como el amoníaco. molécula de amoníaco es una cierta similitud pirámide, el vértice de los cuales es un átomo de nitrógeno y en la parte inferior – tres átomos de hidrógeno. La fórmula de este compuesto – NH3. En condiciones normales, el amoníaco – es un gas incoloro con un olor sofocante agudo. Su densidad a -33,35 ° C (temperatura de ebullición) igual a 0,681 g / cm 3. Una sustancia se funde a -77,7 ° C. Masa molar del amoniaco es de 17 gramos por mol. La presión de 0,9 MPa a temperatura ambiente, hace que el amoníaco a encogerse. Recibe en la industria bajo presión a través de la síntesis catalítica de hidrógeno y oxígeno. Liquid amoniaco – un refrigerante fertilizante altamente concentrado. Con este material debe tener cuidado, porque es tóxico y explosivo.
El nombre de la sustancia derivada de los «Hals ammoniakos» griegas, que se traduce como el amoníaco. molécula de amoníaco es una cierta similitud pirámide, el vértice de los cuales es un átomo de nitrógeno y en la parte inferior – tres átomos de hidrógeno. La fórmula de este compuesto – NH3. En condiciones normales, el amoníaco – es un gas incoloro con un olor sofocante agudo. Su densidad a -33,35 ° C (temperatura de ebullición) igual a 0,681 g / cm 3. Una sustancia se funde a -77,7 ° C. Masa molar del amoniaco es de 17 gramos por mol. La presión de 0,9 MPa a temperatura ambiente, hace que el amoníaco a encogerse. Recibe en la industria bajo presión a través de la síntesis catalítica de hidrógeno y oxígeno. Liquid amoniaco – un refrigerante fertilizante altamente concentrado. Con este material debe tener cuidado, porque es tóxico y explosivo.
datos de Interés
El amoníaco líquido tiene propiedades bastante inusuales. Externamente se asemeja a agua corriente. Como H 2 O, se disuelve perfectamente muchos orgánicos y compuestos inorgánicos. La mayoría de las sales de la misma se disocian en iones cuando se disuelve. Al mismo tiempo, la reacción química, a diferencia del agua, que se produce de manera muy diferente.
|
ZnCl2 |
BaCl2 |
KCl |
NaCl |
KI |
Ba (NO3) 2 |
AgI |
||
|
Solubilidad a 20 ° C por 100 g de disolvente |
amoníaco |
0 |
0 |
0.04 |
3 |
182 |
97 |
207 |
|
agua |
367 |
36 |
34 |
36 |
144 |
9 |
0 |
|
Los datos en esta tabla conduce a la idea de que el amoníaco líquido – un ambiente único para algunas reacciones de intercambio que no son factibles en soluciones acuosas.  Por ejemplo:
Por ejemplo:
2AgCl + Ba (NO3) 2 = 2AgNO 3 + BaCl2.
Debido NH 3 es fuerte aceptor de protones, ácido acético, a pesar de que se considera débil, prodissotsiiruet por completo, tal como lo hacen el ácido fuerte. De mayor interés son soluciones en amoníaco líquido metales alcalinos. De nuevo en 1864, los químicos han dado cuenta de que si se les da un tiempo, el amoníaco se evapora, y en el sedimento serían un metal puro. Lo mismo es cierto con soluciones salinas acuosas. La diferencia es que los metales alcalinos, incluso en pequeñas cantidades, pero sin embargo hace reaccionar con amoníaco, formando de ese modo amidas de sal como:
2Na + 2NH 3 = 2NaNH 2 + H 2.
Estos últimos son sustancias bastante estable, pero en contacto con el agua se desploma inmediatamente:
NaNH2 + H 2 O = NH 3 + NaOH.
 En la investigación de las propiedades de los químicos amoníaco líquido han dado cuenta de que cuando el metal disuelto en la misma, el volumen de la solución se hace más grande. Por otra parte, mientras que su densidad disminuye. Esta es otra diferencia considerado disolvente por agua ordinaria. Es difícil de creer, pero la solución se concentró y se diluyó de cualquier metal alcalino en amoniaco líquido no se mezclan entre sí, a pesar del hecho de que el metal en ambos el mismo! Gracias a los experimentos se encontró constantemente nuevos hechos sorprendentes. Por lo tanto, se encontró que congelado en líquido solución de amoníaco de sodio es muy pequeña resistencia, y por lo tanto, NH 3 se puede utilizar para producir el sistema superconductor. No es sorprendente que este gas y sus soluciones son todavía está interesado en la mente de ambos físicos y químicos.
En la investigación de las propiedades de los químicos amoníaco líquido han dado cuenta de que cuando el metal disuelto en la misma, el volumen de la solución se hace más grande. Por otra parte, mientras que su densidad disminuye. Esta es otra diferencia considerado disolvente por agua ordinaria. Es difícil de creer, pero la solución se concentró y se diluyó de cualquier metal alcalino en amoniaco líquido no se mezclan entre sí, a pesar del hecho de que el metal en ambos el mismo! Gracias a los experimentos se encontró constantemente nuevos hechos sorprendentes. Por lo tanto, se encontró que congelado en líquido solución de amoníaco de sodio es muy pequeña resistencia, y por lo tanto, NH 3 se puede utilizar para producir el sistema superconductor. No es sorprendente que este gas y sus soluciones son todavía está interesado en la mente de ambos físicos y químicos.

















