amoníaco Fórmula. El hidróxido de amonio – amoniaco acuoso
nitruro de hidrógeno – – Amoníaco uno de los más importantes compuestos de nitrógeno y de hidrógeno. Este gas sin color, pero con un olor acre. La composición química refleja la fórmula amoniaco – NH 3. El aumento de presión o disminución de la temperatura del material conduce a que se convierta en un líquido incoloro. El gas de amoníaco y sus soluciones son ampliamente utilizados en la industria y la agricultura. El medicamento se utiliza 10% de hidróxido de amonio – amoniaco.
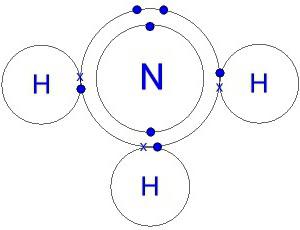
La estructura de la molécula. fórmula amoníaco Electronic
Un nitruro molécula de hidrógeno tiene la forma de una pirámide, la base de los cuales es nitrógeno unido a tres átomos de hidrógeno. N-H enlace está fuertemente polarizado. El nitrógeno es atraído fuertemente par de electrones de enlace. Por lo tanto, una carga negativa se acumula en los átomos de N, el positivos – se centró en hidrógeno. La comprensión de este proceso proporciona un modelo de la molécula, la electrónica y la fórmula estructural de amoníaco.
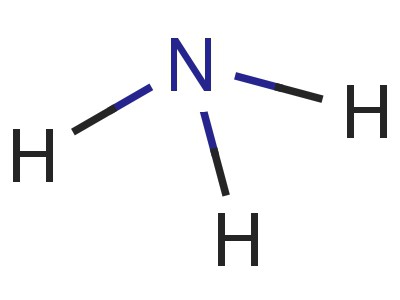
hidrógeno nitruro es muy soluble en agua (700: 1 a 20 ° C). Tener protones sustancialmente libres conduce a la formación de múltiples "puentes" de hidrógeno que conectan entre una molécula. Características de la estructura y enlace químico también conducen al hecho de que el amoníaco es fácilmente licuado mediante el aumento de la presión o la reducción de la temperatura (-33 ° C).

Origen del nombre
El término "amoniaco" se introdujo a la comunidad académica en 1801 a sugerencia del químico ruso Ya Zakharova, pero la sustancia conocida por la humanidad desde tiempos antiguos. Gas con un olor acre liberado durante la descomposición de los productos de desecho de muchos compuestos orgánicos, por ejemplo, proteínas y urea en la descomposición de las sales de amonio. Los historiadores de la química creen que la sustancia fue nombrado después de que el antiguo dios egipcio Amón. Siwa (Amón) es un oasis en el norte de África. Rodeada por el desierto de Libia las ruinas de la antigua ciudad y el templo, junto a la que hay depósitos de cloruro de amonio. Esta sustancia en Europa, llamada "sal de Amón." Se conserva la tradición de que los habitantes del oasis de Siwa olían sal en el templo.
nitruro de hidrógeno
químico Inglés y físico R. Boyle en experimentos quemado estiércol y observa la formación de humo blanco de la torunda sumergido en ácido clorhídrico y la resultante introducido en el chorro de gas. En 1774, otro químico británico J. Priestley calentó cloruro de amonio con cal apagada y gaseoso asignado. Priestley llama compuesto "aire alcalina", debido a que sus propiedades de la solución mostraron una base débil. Recibido explicación experiencia Boyle, en el que el amoniaco se hace reaccionar con ácido clorhídrico. Solid cloruro de amonio blanco se produce tras el contacto de las moléculas reaccionantes en el aire.
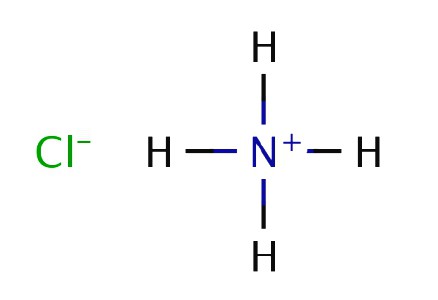
Fórmula química de amoníaco se fijó en 1.875 K. Berthollet por el francés que llevó a cabo un experimento en la descomposición de sustancias en sus componentes constituyentes por la descarga eléctrica. Hasta ahora, los experimentos de Priestley, Boyle Berthollet y se reproducen en el laboratorio para producir nitruro de hidrógeno y cloruro de amonio. método Industrial desarrollado en 1901 por H. Le Chatelier, recibió una patente para un método de síntesis de una sustancia de nitrógeno e hidrógeno.
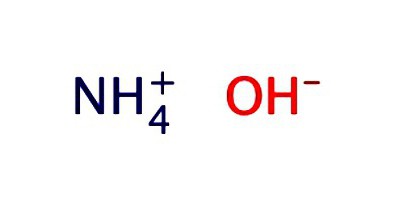
Una solución de amoníaco. Fórmula y propiedades
La solución acuosa de amoníaco se registra típicamente en la forma de hidróxido – NH 4 OH. Expone las propiedades de un álcali débil:
- disocia en iones NH 3 + H 2 O = NH 4 OH = NH 4 + + OH -;
- solución de fenolftaleína tiñe la carmesí;
- se hace reaccionar con un ácido para formar una sal y agua;
- precipitados de Cu (OH) 2 como una sustancia azul brillante cuando se mezcla con sales de cobre solubles.
El equilibrio en la reacción de amoniaco con la interacción de agua se desplaza hacia los materiales de partida. nitruro de hidrógeno precalentado quema bien en oxígeno. Se produce la oxidación de nitrógeno a moléculas diatómicas sustancia simple N2. La reducción de las propiedades también exhibe amoniaco en la reacción con óxido de cobre (II).

Significado de amoníaco y soluciones
Nitruro de hidrógeno usada en la producción de sales de amonio y ácido nítrico – uno de los principales productos de la industria química. El amoníaco es la materia prima para la soda (como método de nitrato). nitruro de contenido de hidrógeno industrialmente solución concentrada alcanza 25%. En agricultura, el uso de amoniaco acuoso. fertilizante líquido Formula – NH 4 OH. La sustancia se utiliza directamente como un apósito superior. Otros métodos de suelo nitrógeno enriquecimiento – el uso de sales de nitratos de amonio, cloruros, fosfatos. En entornos industriales y zonas agrícolas no se recomienda para almacenar juntos fertilizantes que contienen sales de amonio con álcalis. Cuando el material de embalaje rotura puede reaccionar entre sí para formar amoníaco y liberar en los espacios de aire. compuesto tóxico afecta adversamente el sistema respiratorio, el sistema nervioso central. La mezcla de amoníaco con el aire, es explosivo.


















