¿Qué compuestos reacciona de óxido 4 de carbono? ¿Qué sustancias reaccionaron dióxido de carbono?
El dióxido de carbono, también conocido como 4 óxido de carbono reacciona con una serie de sustancias que forman una amplia variedad de composición química y las propiedades del compuesto. Consiste en moléculas no polares, tiene una muy débiles enlaces intermoleculares y sólo puede estar en la forma de gas, si la temperatura es superior a 31 grados Celsius. El dióxido de carbono es un compuesto químico que consta de un átomo de carbono y dos átomos de oxígeno.

El dióxido de carbono 4: Fórmula e información general
El dióxido de carbono presente en la atmósfera a bajas concentraciones, y actúa como un gas de efecto invernadero. Su fórmula química es CO 2. A altas temperaturas, puede existir solamente en el estado gaseoso. En su estado sólido, se llama hielo seco.
El dióxido de carbono es un componente importante del ciclo del carbono. Proviene de una variedad de fuentes naturales incluyendo desgasificación volcánica, la combustión de la materia orgánica y los procesos respiratorios aeróbicas de los organismos vivos. Las fuentes antropogénicas de dióxido de carbono se asocian principalmente con la combustión de diversos combustibles fósiles para la producción de energía y el transporte.

También se produce por diversos microorganismos de fermentación y la respiración celular. Las plantas convierten el dióxido de carbono a oxígeno durante un proceso llamado fotosíntesis, utilizando tanto el carbono y el oxígeno para formar hidratos de carbono. Además, las plantas también liberan oxígeno en la atmósfera, que luego se utiliza para la respiración por organismos heterótrofos.
El dióxido de carbono (CO2) en el cuerpo
El monóxido de carbono se hace reaccionar con 4 sustancias diferentes y un producto de desecho gaseoso del metabolismo. Hay más de 90% de la sangre en la forma de bicarbonato (HCO 3). Else – o bien se disuelve CO 2 o de ácido carbónico (H2CO 3). Para el equilibrio de estos compuestos en los órganos responsables de la sangre tales como el hígado y los riñones. Bicarbonato – es una sustancia química que actúa como un tampón. Se mantiene el pH de la sangre a un nivel deseado, evitando el aumento de la acidez.

La estructura y propiedades de dióxido de carbono
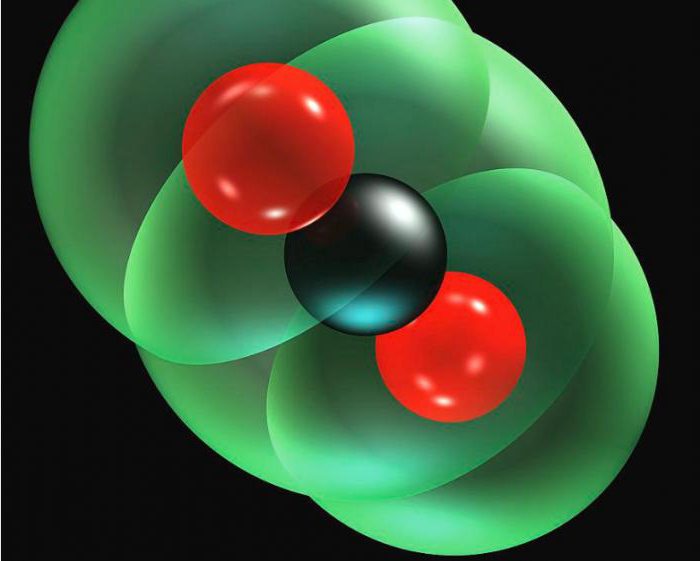
El dióxido de carbono (CO 2) es un compuesto químico que es un gas a temperatura ambiente y por encima. Se compone de un átomo de carbono y dos átomos de oxígeno. Los seres humanos y los animales emiten dióxido de carbono cuando exhale. Por otra parte, siempre se forma cuando algo orgánico en combustión. Las plantas usan dióxido de carbono para la producción de alimentos. Este proceso se llama fotosíntesis.
propiedades de dióxido de carbono fueron estudiados por el científico escocés Joseph Black de vuelta en la década de 1750. Es un gas de efecto invernadero, es capaz de captar la energía térmica y tener un impacto en las condiciones climáticas y meteorológicas en nuestro planeta. Él es la causa del calentamiento global y el aumento de la temperatura de la superficie de la Tierra.
El papel biológico
El monóxido de carbono se hace reaccionar con 4 sustancias diferentes y es el producto final en organismos que reciben energía a partir de la destrucción de los azúcares, las grasas y los aminoácidos. Este es un proceso conocido como la respiración celular, característico de todas las plantas, animales, muchos hongos y algunas bacterias. En los animales superiores, el dióxido de carbono en la sangre se mueve desde los tejidos del cuerpo hasta los pulmones donde se exhala. Las plantas obtenidas a partir de la atmósfera para su uso en la fotosíntesis.
hielo seco
El hielo seco o dióxido de carbono sólido es un CO gas de estado sólido 2 con la temperatura -78,5 ° C. En su forma natural es una sustancia que no se encuentra en la naturaleza, pero hecha por el hombre. Es incoloro y se puede utilizar para la preparación de bebidas carbonatadas, como un elemento de refrigeración en recipientes con helado y en cosmetología, por ejemplo para la congelación de verrugas. Un par de hielo seco puede causar asfixia y conducir a la muerte. Cuando se utiliza hielo seco debe tener cuidado y profesionalismo.
A presión normal, no se derrite de sólido a líquido, y en su lugar se procede directamente de sólido a gas. Esto se llama sublimación. Se va a cambiar directamente de sólido a gas a cualquier temperatura superior a la temperatura extremadamente baja. El hielo seco se sublima a temperaturas normales. Esto libera dióxido de carbono, que no tiene olor y color. El dióxido de carbono puede ser licuado a una presión mayor que 5,1 atm. Gas que se libera desde el frío de hielo seco de forma que, cuando se mezcla con el aire que se enfría el vapor de agua en el aire como niebla, que se parece a un humo blanco denso.
Preparación de propiedades químicas y reacción
En la industria, óxido de carbono 4 se preparó en dos formas:
- Al quemar combustible (+ O C 2 = CO 2).
- Por descomposición térmica de piedra caliza (CaCO 3 = CaO + CO 2).
La cantidad resultante de monóxido de carbono se purifica 4 se licua y se bombea en globos especiales.
Como el ácido, óxido de carbono 4 se hace reaccionar con materiales tales como:
- Agua. Cuando las formas disueltas ácido carbónico (H 2 CO 3).
- Las soluciones alcalinas. 4 El monóxido de carbono (CO fórmula 2) se hace reaccionar con álcalis. En este sal de ácido medio y formado (NaHCO3).
- óxidos básicos. En estas sales reacciones carbonatos formados (CaCO 3 y Na 2 CO 3).
- De carbono. 4 cuando el monóxido de carbono se hace reaccionar con el carbón caliente, 2 está formada de óxido de carbono (monóxido de carbono), que puede causar envenenamiento. (CO 2 + C = 2CO).
- El magnesio. Típicamente, el dióxido de carbono no cede a la combustión, únicamente a temperaturas muy altas, puede reaccionar con ciertos metales. Por ejemplo, un litro de magnesio continuará ardiendo en CO 2 durante la reacción redox (2 mg + CO 2 = 2MgO + C).

reacción cualitativa de monóxido de carbono manifiesta 4 pasándolo a través de una agua de piedra caliza (Ca (OH) 2 o agua a través de barita (Ba (OH) 2. Se puede observar turbidez y precipitación. Si luego continuar fluyendo dióxido de carbono, agua se vuelven transparentes de nuevo , carbonatos insolubles se convierten en hidrógeno carbonatos solubles (sal ácida de ácido carbónico).

El dióxido de carbono también se produce durante la combustión de todos los combustibles a base de carbono, como el metano (gas natural), destilados de petróleo (gasolina, combustible diesel, queroseno, propano), carbón o madera. En la mayoría de los casos, el agua también se pone de relieve.
El dióxido de carbono (dióxido de carbono) se compone de un átomo de carbono y dos átomos de oxígeno que se mantienen juntas mediante enlaces covalentes (o electrones división). carbono puro es muy raro. Se encuentra en la naturaleza sólo en forma de minerales, grafito y diamante. A pesar de esto, es un bloque de construcción de la vida, que en combinación con hidrógeno y oxígeno forma un compuesto básico, todas las cuales consiste en la planeta.
Hidrocarburos tales como carbón, petróleo y gas natural – un compuesto que consiste en carbono e hidrógeno. Este elemento está contenido en calcita (CaCO3) y minerales en rocas sedimentarias y metamórficas piedra caliza y mármol. Este elemento, que comprende toda la materia orgánica – de combustibles fósiles a ADN.




















