La hidratación de propileno: reacción Ecuación
Las sustancias orgánicas tienen un lugar importante en nuestras vidas. Ellos son los principales componentes poliméricos que están a nuestro alrededor: es bolsas de plástico y caucho, así como muchos otros materiales. Polipropileno cubre en esta serie no es el último paso. También se incluye en los diversos materiales y se utiliza en muchas industrias como la construcción, el uso en el hogar como material para vasos de plástico y otros (producción, pero no en escala) pequeña necesita. Antes de hablar de un proceso de este tipo, ya que la hidratación de propileno (por el cual, por cierto, podemos obtener alcohol isopropílico), mirar la historia del descubrimiento de esta sustancia esencial para la industria.
historia
Como tal, la fecha de apertura del propileno no lo hace. Sin embargo, su polímero – Polipropileno -era en realidad se abrió en 1936 por el famoso químico alemán Otto Bayer. Por supuesto, en teoría, era conocido como uno puede conseguir un asunto tan importante, pero en la práctica esto no tiene éxito. Sólo tuvo éxito en la químicos italianos mediados del siglo XX, cuando alemán y y Ziegler Nutt abrió catalizador insaturado polimerización de hidrocarburos (que tiene uno o más dobles enlaces), que es posteriormente y con nombre: catalizadores de Ziegler-Natta. Hasta este punto que era absolutamente imposible hacer la reacción de polimerización de tales sustancias ha ido. Eran conocidos reacción de policondensación, cuando el catalizador sin afectar la sustancia conectado a la cadena polimérica, formando de este modo subproductos. Pero con los hidrocarburos insaturados no tienen éxito.
Otro proceso importante asociado con esta sustancia, era su hidratación. Propileno durante el comienzo de su uso era bastante. Y todo esto gracias a las diversas compañías de procesamiento de petróleo y gas inventado una cura propeno (también conocida como una sustancia descrita a veces). El craqueo de petróleo crudo era un subproducto, y cuando resultó que un derivado del mismo, alcohol isopropílico, es la base para la síntesis de muchas sustancias útiles para la humanidad, muchas empresas, tales como de BASF, patentó su método de producción y lanzó un comercio masivo en esta conexión. Propileno La hidratación fue probado y se aplica antes de la polimerización es la razón por acetona, peróxido de hidrógeno, isopropilamina comenzaron antes para producir polipropileno.
Un proceso muy interesante de separación de propeno a partir del petróleo. A él nos dirigimos ahora.
Aislamiento de propileno
En realidad, en una comprensión teórica del método básico es a un solo proceso: aceite de pirólisis y los gases asociados. Pero ahora implementaciones de tecnología – sólo un mar. El hecho es que cada empresa busca obtener una forma única y proteger su patente y otras empresas similares también están buscando sus propias maneras de hacer y vender todavía propeno como materia prima o convertirlo en una variedad de productos.
De pirólisis ( "Pyro" – fuego "lys" – destrucción) – moléculas proceso de descomposición química complicadas y grandes en otros más pequeños bajo la influencia de la alta temperatura y el catalizador. Aceite, como se sabe, es una mezcla de hidrocarburos consta de luz, medio y fracciones pesadas. Desde el primero, el peso molecular muy bajo, y son propeno y etano en la pirólisis. Este proceso se lleva a cabo en hornos especiales. En los fabricantes más avanzados de la tecnología de proceso es diferente: un poco de arena se utiliza como refrigerante, el otro – de cuarzo, y otros – de coque; También puede dividir el horno en su estructura: no son tubulares y convencional, como se les llama reactores.
Pero el proceso de pirólisis produce suficiente prop limpio, ya que, además de él, se forma una gran cantidad de hidrocarburos, que luego tiene que dividir maneras bastante alto consumo de energía. Por lo tanto, para obtener un material puro tal como se utiliza para la deshidrogenación de alcanos, seguido de hidratación: en nuestro caso – propano. Así como el proceso de polimerización descrito anteriormente simplemente no sucede. La escisión de molkuly hidrógeno limitante de hidrocarburos se produce bajo la acción de catalizadores de óxido de cromo trivalente y óxido de aluminio.
Pero antes de pasar a la historia de cómo el proceso de hidratación, mirar la estructura de nuestros hidrocarburos insaturados.
Especialmente estructura propileno
Propen sí mismo – sólo el segundo miembro de un número de alquenos (hidrocarburos con un enlace doble). Para mayor facilidad, que ocupa el segundo lugar al etileno (de los cuales, como se puede adivinar, hacer de polietileno – el peso de polímero en el mundo). En los propen estado normal – gas como su "relativo" de la familia de los alcanos, propano.
Sin embargo, un propano diferencia significativa de propeno – es que esta última tiene en su composición un doble enlace, que cambia radicalmente sus propiedades químicas. Permite la conexión a una molécula de hidrocarburo insaturado otras sustancias, por el que un compuesto obtenido con propiedades completamente diferentes a menudo es muy importante para la industria y el hogar.
Es hora de hablar de la teoría de la reacción, lo que, de hecho, el tema de este artículo. En la siguiente sección, usted aprenderá que forman uno de los productos de mayor importancia comercial, y cómo lo hace esta reacción y cuáles son los matices en ella cuando propileno hidratación.

La teoría de la hidratación
Para empezar, volvamos a un proceso más general – solvatación – que incluye también la reacción descrita anteriormente. Esta conversión química, que consiste en unir las moléculas de disolvente a las moléculas del soluto. Así pueden formar una nueva molécula, o los llamados solvatos, – partículas que consisten en las moléculas de soluto y solvente interacción electrostática relacionada. Nos interesa sólo el primer tipo de materiales, porque cuando la hidratación de propileno se forma preferentemente de tal producto.
En lo anterior solvatación método moléculas de disolvente están unidos al soluto, obtenido nuevo compuesto. En química orgánica formada ventajosamente durante alcoholes de hidratación, cetonas y aldehídos, pero hay algunos otros casos, tales como la formación de glicoles, pero no van a ser discutidos. De hecho, este proceso es muy simple, pero al mismo tiempo es bastante complicado.
mecanismo de hidratación
doble enlace, como se sabe, consiste en dos tipos de enlaces atómicos: enlaces pi y sigma. Pi-enlace roto después de la hidratación siempre la primera reacción, ya que es menos fuerte (tiene una energía de enlace más pequeño). En su ruptura forma dos orbitales vacantes de los dos átomos de carbono adyacentes que pueden formar nuevos bonos. Una molécula de agua que existe en solución en forma de dos partículas de ion hidróxido y de protones, capaz de unir explotó doble enlace. En donde el ion hidróxido está unido al átomo de carbono central y el protón – al segundo extremo. Por lo tanto, en la hidratación de propileno se forma predominantemente 1-propanol, o alcohol isopropílico. Este es un asunto muy importante, ya que es posible obtener la oxidación de acetona, se utiliza en grandes cantidades en nuestro mundo. Se nos dice que está formado predominantemente, pero esto no es cierto. Debo decir esto: el único producto formado por la hidratación de propileno, y esto – alcohol isopropílico.
Esto, por supuesto, todas las sutilezas. De hecho, todo puede ser mucho más fácil de describir. Y ahora sabemos cómo escribir un curso de un proceso, como la hidratación de propileno.
Reacción: cómo sucede
En química para denotar todo es simple: con la ayuda de la ecuación de reacción. Esa transformación química de la materia en discusión puede ser descrito de esta manera. La hidratación de propileno, la ecuación de la reacción es muy simple y se realiza en dos etapas. En primer lugar romper el enlace pi, parte de un doble. Entonces la molécula de agua en forma de dos partículas de anión hidróxido y catión hidrógeno, adecuados para la molécula de propileno que tiene tiempo activo de dos puestos vacantes para formar enlaces. ion hidróxido forma un enlace con el átomo de carbono menos hidrogenado (es decir, con, a la que una cantidad mínima de átomos de hidrógeno), y un protón, respectivamente, – con el restante extremo. Por lo tanto, un solo producto de: limitar el alcohol monohídrico es isopropanol.
Cómo grabar una respuesta?
Ahora vamos a aprender cómo escribir el idioma de la reacción química, lo que refleja un proceso como la hidratación de propileno. Una fórmula que es útil para nosotros: CH2 = CH – CH 3. Esta es la fórmula del material de partida – propeno. Como se puede ver, tiene un doble enlace se indica por el signo "=", y en este lugar se prisoednyatsya agua cuando se produzca la hidratación de propileno. Ecuación de reacción se puede escribir como: CH2 = CH – CH 3 + H 2 O = CH 3 – CH (OH) – CH 3. El grupo hidroxilo en el paréntesis significa que esta parte no está en el plano de la fórmula, y debajo o por encima. Aquí no podemos mostrar los ángulos entre los tres grupos, que se extiende desde el átomo de carbono medio, pero decir que son aproximadamente iguales entre sí y completar hasta 120 grados.
¿Dónde se utiliza?
Ya hemos mencionado que obtengan en el desempeño de la sustancia de reacción es ampliamente utilizado para la síntesis de otras sustancias vitales para nosotros. Es muy similar en estructura a la acetona, de la que difiere sólo en que en vez de pie allí ceto gidroksogrupp (es decir, átomo de oxígeno conectados por un doble enlace a un átomo de nitrógeno). Como se sabe, acetona sí mismo se utiliza en barnices y disolventes, pero además, se utiliza como reactivo para la síntesis adicional de sustancias más complejas, tales como poliuretanos, resina epoxi, anhídrido acético , y así sucesivamente.
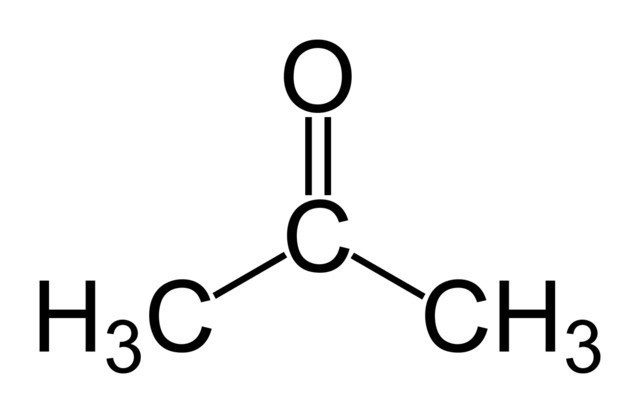
acetona reacción de producción
Creemos que es útil para describir la transformación de alcohol isopropílico, acetona, sobre todo porque esta reacción no es tan complicado. Para empezar, propanol y se evapora a 400-600 grados Celsius oksilyayut oxígeno a un catalizador especial. Un producto muy puro se obtiene llevando a cabo la reacción en una malla de plata.

ecuación de reacción
No vamos a entrar en detalles del mecanismo de reacción para la oxidación de propanol en acetona, ya que es muy complejo. Confinar ecuación de conversión química convencional: CH 3 – CH (OH) – CH 3 + O 2 = CH 3 – C (O) – CH 3 + H 2 O. Como se muestra en el Esquema todos bastante simple, pero es necesario profundizar más en el proceso, y vamos a hacer frente a una serie de dificultades.
conclusión
Así que desmanteló el proceso de hidratación de propileno y la ecuación para la reacción estudiada y el mecanismo de su ocurrencia. Considerados los principios tecnológicos son la base de los procesos reales que tienen lugar en la industria. Al final resultó que, no son muy complejos, pero tienen un beneficio real para nuestra vida cotidiana.


















