Los halógenos: propiedades físicas, propiedades químicas. El uso de los compuestos de halógenos y su
Los halógenos en la tabla periódica a la izquierda de los gases nobles. Estos cinco elementos metálicos tóxicos incluidos en el grupo 7 de la Tabla Periódica. Estos incluyen flúor, cloro, bromo, yodo y astato. Aunque sólo una vida corta isótopos de astato radiactivo y tiene, se comporta como yodo y, a menudo se considera halógenos. Como los elementos halógenos son siete electrones de valencia, que necesita sólo un electrón extra para formar un octeto completo. Esta característica los hace más activo que otros grupos de los no metales.
características generales
Los halógenos forman una molécula diatómica (X 2 tipo en el que X es un halógeno) – halógenos existencia de forma estable células libres. Contacto de moléculas diatómicas son no polares, y la única covalente. Las propiedades químicas de halógenos les permiten formar fácilmente compuestos con la mayoría de los elementos, por lo que nunca se encuentran en la forma no unida en la naturaleza. Fluoro – halógeno más activo y astato – menos.
Todos los grupos halógenos I forman sales con propiedades similares. En estos compuestos, los haluros se presente como un anión haluro con una carga de -1 (por ejemplo, Cl -, Br -). Finalización de -id indica la presencia de aniones haluro; por ejemplo, Cl – llamada "cloruro".
Además, las propiedades químicas de halógenos les permiten actuar como agentes oxidantes – metales oxidados. mayoría de las reacciones químicas que implican halógenos – redox en solución acuosa. Los halógenos forman enlaces individuales con carbono o nitrógeno en compuestos orgánicos, donde el grado de oxidación (CO) es igual a -1. Cuando está sustituido por un átomo de hidrógeno unido covalentemente átomo de halógeno en un compuesto orgánico, prefijo de halo se puede utilizar en un sentido general, o prefijos fluoro-, cloro-, bromo-, yodo- – halógenos específicos. elementos halógenos pueden tener un enlace cruzado para formar moléculas diatómicas con enlaces sencillos covalentes polares.
El cloro (Cl 2) fue el primero halógeno abrió en 1774, a continuación, se abrió el yodo (I 2), bromo (Br 2), flúor (F 2) y astato (At, encontrado pasado en 1940 YG). El nombre "halógeno" se deriva de la raíz griega hal ( «sal») y -Gén ( «forma»). En conjunto, estas palabras significan "formador de sal", haciendo hincapié en el hecho de que el halógeno reacciona con metales para formar sales. Halita – el nombre de sal de roca, mineral natural compuesto de cloruro de sodio (NaCl). Por último, el halógeno utilizado en el hogar – contiene fluoruro en la pasta de dientes, cloro desinfectar agua potable, yodo y promueve el desarrollo de las hormonas tiroideas.
elementos químicos
Fluoro – elemento con número atómico 9, se denota por F. El flúor elemental fue descubierto por primera vez en 1886 g por aislándolo del ácido fluorhídrico.. En el estado libre que existe en la forma de las moléculas diatómicas de flúor (F 2) y es el halógeno más común, en la corteza. Fluoro – elemento más electronegativo de la tabla periódica. A temperatura ambiente, un gas de color amarillo pálido. El flúor también tiene un radio relativamente pequeño atómica. Su CO – -1 excepto estado diatómico elemental en la que su estado de oxidación es cero. Fluoro extremadamente químicamente activa e interactúa directamente con todos los elementos excepto el helio (He), neón (Ne) y argón (Ar). La solución de H 2 O, ácido fluorhídrico (HF) es un ácido débil. Aunque fluoro altamente electronegativo, su electronegatividad no determina la acidez; HF es un ácido débil debido al hecho de que el ion fluoruro es básica (pH> 7). Además, fluoro produce oxidantes muy potentes. Por ejemplo, flúor puede reaccionar con el xenón gas inerte y forma un fuerte difluoruro de oxidante xenón (XeF 2). En muchas aplicaciones de fluoruro.

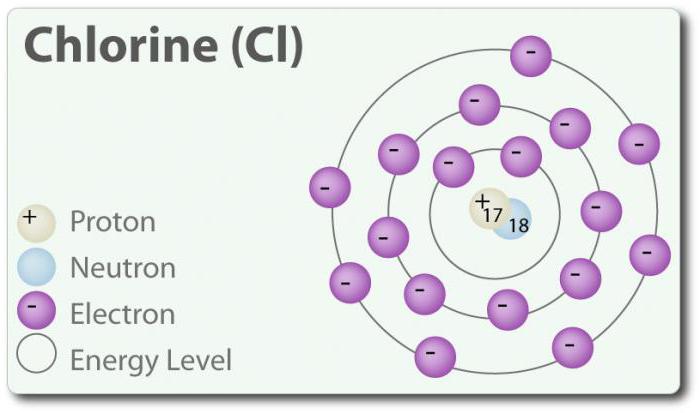
Cloro – elemento con número atómico 17 y el símbolo químico Cl. Descubierto en 1774 por g. Distinguirla de ácido clorhídrico. En su estado elemental que se forme una molécula diatómica Cl 2. El cloro tiene varios SB -1, 1, 3, 5 y 7. A temperatura ambiente es gas de color verde claro. Puesto que el enlace que se forma entre los dos átomos de cloro, es débil, Cl 2 molécula tiene una muy alta capacidad de entrar en la conexión. El cloro reacciona con los metales para formar sales, que se llaman cloruros. Los iones cloruro son los iones más abundantes contenidos en el agua de mar. El cloro también tiene dos isótopos: 35 Cl y 37 Cl. El cloruro de sodio es la conexión más común de todos los cloruros.
El bromo – un elemento químico con el número atómico 35 y símbolo Br. Se descubrió por primera vez en 1826 en forma de bromo elemental es molécula diatómica, Br 2. A temperatura ambiente, es un líquido de color marrón rojizo. Su CO – -1, + 1, 3, 4 y 5. Bromo más activo que el yodo, pero son menos activos que el cloro. Además, isótopo bromo tiene dos 79 Br y 81 Br. El bromo se produce en la forma de sales de bromuro, disuelto en agua de mar. En los últimos años, la producción de bromuro en el mundo ha aumentado significativamente debido a su disponibilidad y larga vida. Como con otros halógenos bromo y el oxidante es muy tóxico.

El yodo – elemento químico con número atómico 53 y el símbolo I. La oxidación de yodo tiene: -1, +1, +5 y +7. Hay en la forma de una molécula diatómica, I 2. A temperatura ambiente la sustancia sólida es de color púrpura. El yodo tiene un isótopo estable – 127 I. Primero descubierto en 1811, con la ayuda de las algas y el ácido sulfúrico. Actualmente, los iones de yodo se pueden aislar en el agua de mar. A pesar del hecho que el yodo no es muy soluble en agua, su solubilidad se puede incrementar cuando se utiliza yoduros separadas. El yodo juega un papel importante en el cuerpo, la participación en la producción de hormonas tiroideas. 
El astato – un elemento radiactivo con el número atómico 85 y símbolo At. Su posible oxidación afirma -1, 1, 3, 5 y 7. El único halógeno que no es una molécula diatómica. En condiciones normales, un material duro metálico negro. Astato es un elemento muy raro, se sabe muy poco acerca de él. Además, astato tiene una vida media corta, no más de unas pocas horas. Recibió en 1940 como resultado de la síntesis. Se cree que astato similar a yodo. Caracterizados propiedades metálicas.
La siguiente tabla muestra la estructura de los átomos de halógeno, la estructura de la capa externa de electrones.
|
halógeno |
La configuración del electrón |
|
flúor |
1s 2 2s 2 2p 5 |
|
cloro |
2 3s 3p 5 |
|
bromo |
3d 10 4s 2 4p 5 |
|
yodo |
4d 2 10 5s 5p 5 |
|
astato |
4f 14 5d 10 6s 2 6p 5 |
Dicha estructura hace que la capa exterior de electrones que las propiedades físicas y químicas similares a los halógenos. Sin embargo, al comparar estos elementos y las diferencias observadas.
Propiedades periódicas grupo halógeno
Las propiedades físicas de las sustancias simples de halógeno cambiaron con el aumento del número ordinal del elemento. Para una mejor absorción y una mayor claridad, le ofrecemos unas cuantas mesas.
Los puntos de fusión y ebullición en el grupo se incrementa con el aumento de tamaño de la molécula (F <Cl <Br <I <At). Este aumento significa un aumento Fuerzas de Van der Waals.
Tabla 1. Los halógenos. Propiedades físicas: punto de fusión y punto de ebullición
|
halógeno |
De fusión T (ºC) |
Boiling T (C) |
|
flúor |
-220 |
-188 |
|
cloro |
-101 |
-35 |
|
bromo |
-7.2 |
58.8 |
|
yodo |
114 |
184 |
|
astato |
302 |
337 |
- Los atómico aumenta RADIUS.
aumenta el tamaño del núcleo (F <Cl <Br <I <A), ya que aumenta el número de protones y neutrones. Además, con cada período añade más y más niveles de energía. Esto conduce a orbitales más altos y, en consecuencia, a un aumento en el radio del átomo.
Tabla 2: halógeno. Propiedades físicas: radios atómicos
|
halógeno |
El radio covalente (pm) |
Ion (X -) Rango (pm) |
|
flúor |
71 |
133 |
|
cloro |
99 |
181 |
|
bromo |
114 |
196 |
|
yodo |
133 |
220 |
|
astato |
150 |
- energía de ionización disminuye.
Si los electrones de valencia externos no están situados cerca del núcleo, para su eliminación no requiere una gran cantidad de energía de ella. Por lo tanto, la energía necesaria para la expulsión del electrón exterior no es tan alta en la parte inferior de un grupo de elementos, ya que hay más niveles de energía. Además, la alta ionización de energía hace que el elemento para mostrar la calidad no metálico. propiedades metálicas debido a que la energía de ionización se reduce (a <I <Br <Cl <F) de yodo y astato pantalla show.
Tabla 3. halógenos. Propiedades físicas: energía de ionización
|
halógeno |
La energía de ionización (kJ / mol) |
|
flúor |
1681 |
|
cloro |
1251 |
|
bromo |
1140 |
|
yodo |
1008 |
|
astato |
890 ± 40 |
- Electronegatividad disminuye.
El número de electrones de valencia en un átomo aumenta con el aumento los niveles de energía en niveles progresivamente más bajos. Los electrones son progresivamente más lejos desde el núcleo; Por lo tanto, el núcleo y los electrones no son como se atraen entre sí. El aumento de la proyección allí. Por lo tanto Electronegatividad disminuye con el período creciente (a <I <Br <Cl <F).
Tabla 4. halógenos. Propiedades físicas: electronegatividad
|
halógeno |
electronegatividad |
|
flúor |
4.0 |
|
cloro |
3.0 |
|
bromo |
2.8 |
|
yodo |
2.5 |
|
astato |
2.2 |
- afinidad electrónica disminuye.
Dado que el tamaño de un átomo aumenta con el tiempo, la afinidad de electrones se reduce en general (B <I <Br <F <Cl). Excepción – flúor, afinidad que es menor que el de cloro. Esto se puede explicar por un tamaño más pequeño en comparación con el flúor y el cloro.
Tabla 5. afinidad electrónica halógeno
|
halógeno |
afinidad electrónica (KJ / mol) |
|
flúor |
-328.0 |
|
cloro |
-349.0 |
|
bromo |
-324.6 |
|
yodo |
-295.2 |
|
astato |
-270.1 |
- elementos de reactividad disminuye.
Reactividad de halógeno disminuye con el período creciente (a <I <Br <Cl <F). Esto es debido al aumento de la radio del átomo con el aumento de los niveles de energía de electrones. Esto reduce la atracción de electrones de valencia de otros átomos reductores reactividad. Esta reducción también se produce debido a los aumentos de época electronegatividad que caen, que también reduce la atracción de electrones. Además, al aumentar el tamaño del átomo y reducido poder oxidante.

Química inorgánica. Hidrógeno + halógenos
Halide forma cuando halógeno se hace reaccionar con otro elemento, menos electronegativo para formar un compuesto binario. El hidrógeno reacciona con halógenos para formar haluros de tipo HX:
- fluoruro de hidrógeno HF;
- cloruro HCl;
- bromuro de hidrógeno HBr;
- hidrógeno HI yoduro.
haluros de hidrógeno se disuelven fácilmente en agua para formar un hidrácido halogenado (fluorhídrico, ácido clorhídrico, bromhídrico, yodhídrico). Las propiedades de estos ácidos se dan a continuación.
Los ácidos formados por la reacción siguiente: HX (aq) + H 2 O (l) → X – (aq) + H 3 O + (aq).
Todo haluro de hidrógeno para formar ácido fuerte, excepto HF.
Acidez aumenta hidrácidos halogenados: HF <HCl <HBr <HI.
El ácido fluorhídrico se puede grabar el vidrio y ciertos fluoruros inorgánicos mucho tiempo.
Puede parecer ilógico que HF es el hidrácido halogenado más débil, ya que el flúor en sí tiene alta electronegatividad. Sin embargo H-F enlace es muy fuerte, lo que resulta en un ácido muy débil. Una relación fuerte se define por una longitud de enlace corto y una energía de disociación grande. De todos los halogenuros de hidrógeno HF tiene la longitud de la conexión más corta y la más grande de la energía de disociación de enlace.
oxoácidos de halógeno
oxoácidos de halógeno son ácidos con átomos de hidrógeno, oxígeno y halógeno. Su acidez puede determinarse mediante el análisis de la estructura. oxoácidos de halógenos se presentan a continuación:
- El ácido hipocloroso, HOCl.
- Cloroso ácido HClO 2.
- Clórico ácido HClO 3.
- Ácido perclórico HClO 4.
- ácido hipobromoso, HOBr.
- ácido brómico, HBrO 3.
- Perbrómico ácido HBrO 4.
- IOH ácido hipoyodoso.
- HIO ácido yódico 3.
- Metayodnaya ácido HIO4, H5IO6.
En cada uno de estos ácidos de protones unidos al átomo de oxígeno, por lo que la comparación de las longitudes de enlace protones son inútiles. El papel dominante se juega aquí por la electronegatividad. La acidez aumenta con el número de átomos de oxígeno unidos al átomo central.
La apariencia y estado de la materia
Las propiedades físicas básicas de los halógenos pueden expresarse brevemente en la siguiente tabla.
|
condición de sustancias (a temperatura ambiente) |
halógeno |
apariencia |
|
firme |
yodo |
púrpura |
|
astato |
negro |
|
|
líquido |
bromo |
bermejo |
|
gaseoso |
flúor |
pálido amarillo-marrón |
|
cloro |
verde pálido |
explicación apariencia
El color es un resultado de halógenos absorción de la luz visible por las moléculas causantes de electrones excitados. Fluoro absorbe la luz violeta, y por consiguiente se ve de color amarillo pálido. El yodo, por el contrario, absorbe la luz amarilla y se ve de color púrpura (color amarillo y morado – colores complementarios). el color se vuelve más oscura halógeno con el aumento de tiempo.

Los recipientes sellados de bromo líquido y yodo sólido están en equilibrio con su vapor, que se puede observar como un gas coloreado.
Aunque el desconocido de color astato, se cree que debería ser un yodo oscuro (t. E. Black) de acuerdo con el patrón observado.
Ahora bien, si se le pidió: "Describir las propiedades físicas de los halógenos," que va a decir.
El grado de oxidación de halógenos en compuestos
El grado de oxidación se utiliza a menudo en lugar de "valencia de halógenos." Típicamente, el estado de oxidación igual a -1. Pero si el halógeno está unido a otro oxígeno o halógeno, puede tomar otros estados: oxígeno -2 SB tiene prioridad. En caso de dos átomos de halógeno diferentes unidas entre sí más átomo electronegativo predomina y toma CO -1.
Por ejemplo, en el cloruro de yodo (ICl) es cloro CO -1, +1 y yodo. El cloro es más electronegativo que el yodo, por lo tanto el CO es igual a -1.
El (HBrO 4) de oxígeno ácido brómico tiene un CO -8 (-2 x 4 = -8 átomo). El hidrógeno tiene un número de oxidación total 1. La adición de estos dos valores da CO -7. Puesto que el compuesto final SB debería ser cero, el CO es de siete bromo.
La tercera excepción a esta regla es el grado de oxidación del halógeno en forma de elementos (X 2), donde su CO es igual a cero.
|
halógeno |
En los compuestos de la CO |
|
flúor |
-1 |
|
cloro |
-1, 1, 3, 5, 7 |
|
bromo |
-1, +1, +3, +4, +5 |
|
yodo |
-1, 1, 5, 7 |
|
astato |
-1, 1, 3, 5, 7 |
¿Por qué con flúor siempre es -1?
Electronegatividad aumenta con el tiempo. Por lo tanto, el flúor tiene la más alta electronegatividad de todos los elementos, como se evidencia por su posición en la tabla periódica. Su configuración electrónica 1s 2 2s 2 2p 5. Si fluoruro consigue otro electrón, orbitales p extremas están completamente llenos y forman un octeto completo. Debido a que el flúor tiene una alta electronegatividad, puede seleccionar fácilmente un electrón de una átomos vecinos. El flúor en este caso isoelectrónico gas inerte (con ocho electrones de valencia) y todos sus orbitales externos llenos. En este estado, el flúor es mucho más estable.
La preparación y uso de halógenos
En la naturaleza, los halógenos son en el anión, por lo que el halógeno libre es producido por la oxidación por electrólisis o por oxidantes. Por ejemplo, el cloro se genera por hidrólisis de una solución de cloruro de sodio. El uso de halógenos y sus compuestos diversos.
- El fluoruro. A pesar del hecho de que el flúor es muy reactivo, se utiliza en muchas industrias. Por ejemplo, es un componente clave de politetrafluoroetileno (PTFE) y otros polímeros fluorados. Los clorofluorocarbonos son orgánicos productos químicos que han sido previamente utilizados como refrigerantes y propelentes en aerosoles. Su aplicación se ha detenido debido a su posible impacto en el medio ambiente. Fueron reemplazados por los hidroclorofluorocarbonos. El flúor se añade a la pasta de dientes (SNF 2) y agua potable (NaF) para prevenir la caries dental. El halógeno está contenida en la arcilla utilizada para producir ciertos tipos de cerámica (LIF), utilizados en la energía nuclear (UF 6) para obtener un antibiótico de fluoroquinolona, alúmina (Na 3 AlF 6) para el aislamiento de equipos de alta tensión (SF 6).
- El cloro también encontrar una variedad de usos. Se utiliza para la desinfección de agua potable y piscinas. El hipoclorito de sodio (NaClO) es el principal componente de los agentes de blanqueo. El ácido clorhídrico se utiliza ampliamente en la industria y laboratorios. El cloro presente en el cloruro de polivinilo (PVC) y otros polímeros que se utilizan para cables de aislamiento, tubos y electrónica. Por otra parte, el cloro ha sido útil en la industria farmacéutica. Los medicamentos que contienen cloro, se utilizan para tratar las infecciones, alergia y diabetes. forma de clorhidrato Neutral – un componente de muchos fármacos. El cloro también se usa para esterilizar equipos hospitalarios y desinfección. En la agricultura, el cloro es un componente de muchos pesticidas comerciales DDT (dihlorodifeniltrihloretan) fue utilizado como insecticida agrícola, pero su uso se suspendió.

- El bromo, debido a su no inflamabilidad, que se utiliza para inhibir la combustión. También contiene bromuro de metilo, un pesticida utilizado para el almacenamiento de los cultivos y la supresión de bacterias. Sin embargo, el uso excesivo de bromuro de metilo se ha interrumpido debido a su impacto sobre la capa de ozono. El bromo se utiliza en la producción de gasolina, película fotográfica, extintores de incendios, medicamentos para el tratamiento de la neumonía y la enfermedad de Alzheimer.
- El yodo juega un papel importante en el buen funcionamiento de la glándula tiroides. Si el cuerpo no recibe suficiente yodo, se incrementa la glándula tiroides. Para la prevención del bocio halógeno activo añadido a la sal de mesa. El yodo también se utiliza como un antiséptico. El yodo está contenido en las soluciones utilizadas para la purificación de heridas abiertas y también en aerosoles desinfectantes. Además, el yoduro de plata es importante en la imagen.
- El astato – halógeno tierra radiactivos y raro, no se utiliza de manera más. Se cree que este elemento puede ayudar al yodo en la regulación de las hormonas tiroideas.