Molécula: un peso molécula. El tamaño y la masa de las moléculas
La composición de materiales complejos, a pesar de que están formados por partículas diminutas – átomos, moléculas, iones. La estructura molecular tiene muchos líquidos y gases, así como un cuerpo sólido. Los átomos y iones comprenden metales, muchas sales. Todas las partículas tienen masa, incluso la molécula más pequeña. Masa de la molécula, si lo expresamos en los kilos, recibe un valor muy pequeño. Por ejemplo, M (H 2 O) = 30 • 10 -27 kg. Tales características importantes de una sustancia como el peso y dimensiones de las micropartículas, durante mucho tiempo ha sido estudiado físicos y químicos. Se establecieron las bases en las obras de Mikhail Lomonosov y Dzhona Daltona. Tenga en cuenta cómo cambió desde puntos de vista sobre el microcosmos.
Universidad de presentación "corpúsculos"
La asunción de la discreta estructura de la materia expresada por los estudiosos de la antigua Grecia. Luego se le dio el nombre de "átomo" la partícula indivisible más pequeña de los cuerpos, "bloques de construcción" del universo. El gran erudito ruso M. V. Lomonosov escribió acerca de la física insignificante e indivisible significa estructura de las partículas de la materia – corpúsculo. Más tarde, en las publicaciones de otros investigadores, la nombraron "molécula".
molécula de masas y sus dimensiones están determinadas por las propiedades de sus átomos constituyentes. Durante mucho tiempo, los científicos no han sido capaces de mirar más profundamente en el microcosmos que impidió el desarrollo de la química y la física. Lomonosov instó repetidamente colegas para aprender y en su trabajo basado en datos cuantitativos exactos – una "medida y peso." A través del trabajo de químico ruso y físico sentado las bases de la doctrina de la estructura de la materia, que se han convertido en una parte integral de la teoría atómica molecular coherente.

Los átomos y las moléculas – "bloques de construcción del universo"
Incluso microscópicamente pequeños objetos difíciles de encontrar, que tienen diferentes propiedades. Las partículas tales como átomos, formados por el núcleo y las capas electrónicas difieren en el número de cargas positivas y negativas radio de peso. existen átomos y moléculas en la composición de sustancias, no en forma aislada, que se sienten atraídos diferente fuerza. efecto más notable de las fuerzas de atracción en sólidos, más débil – en líquidos, apenas se siente en las sustancias gaseosas.
Las reacciones químicas no van acompañadas de átomos de destrucción. Muy a menudo, hay un reagrupamiento de ellos, hay otra molécula. molécula de masas depende de lo que los átomos que se forma. Pero con todos los cambios en los átomos son indivisibles químicamente. Sin embargo, pueden formar parte de diferentes moléculas. Los átomos retienen las propiedades del elemento al que el. Molécula antes de decaer en átomos conserva todos los atributos de la sustancia.
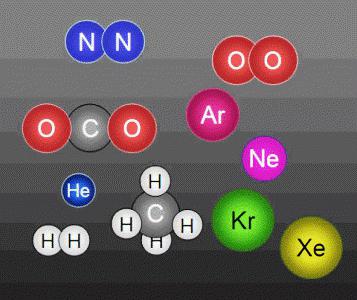
estructura de Micropartículas de los cuerpos – la molécula. masa de la molécula
Para medir las macrobodies de masas se utilizan dispositivos, la más antigua de las cuales – escalas. El resultado de la medición se prepara convenientemente en kilogramos, como la unidad básica de las magnitudes físicas del sistema internacional (SI). Para determinar la masa molecular en kilogramos, es necesario establecer sus pesos atómicos basado en el número de partículas. Para mayor comodidad, una unidad especial de la masa se ha introducido – nuclear. Se puede escribir en forma de abreviaturas de letras (uma). Esta unidad corresponde a una doceava parte de la masa del nucleido de carbono 12 C.
Si expresamos el valor encontrado en las unidades estándar, obtenemos 1,66 • 10 -27 kg. Tales pequeños indicadores para los cuerpos de masa operan principalmente la física. El artículo es una tabla de la que se puede aprender lo que son las masas de los átomos de ciertos elementos químicos. Para averiguar lo que es la masa de una molécula de hidrógeno en kilogramos, se multiplica por dos que se muestran en la tabla de la masa atómica del elemento químico. El resultado es una molécula de valor de peso que consisten en dos átomos.
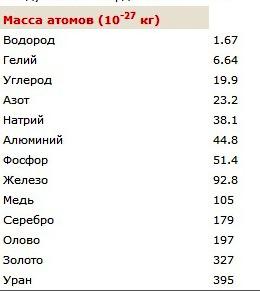
Masa molecular relativa
Es difícil de operar en el cálculo de cantidades muy pequeñas, es inconveniente, conduce a consumen mucho tiempo y propenso a errores. Como para el peso de las micropartículas, a continuación, la liberación de la difícil situación fue el uso de valores relativos. Familiar para los químicos término se compone de dos palabras – "masa atómica", su símbolo – Ar. concepto idéntico se introdujo en el peso molecular (la misma que la masa de la molécula). La fórmula que relaciona las dos cantidades: Mr = m (un blanco) / 1/12 m (12 C).
A menudo se puede escuchar lo que dicen "peso molecular". Este término obsoleto utilizado incluso con respecto al peso molecular, pero con menos frecuencia. El hecho de que el peso – es una cantidad física diferente – el poder de la cual depende de las coordenadas geográficas del cuerpo. En contraste, la masa es una característica constante de las partículas que participan en procesos químicos, y se mueven a velocidad normal.

Cómo determinar el peso molecular
La definición exacta del peso molécula se realiza por el instrumento – espectrómetro de masas. Para resolver los problemas, se puede utilizar la información de la tabla periódica. Por ejemplo, la masa de una molécula de oxígeno es 2 • 16 = 32. Llevamos a cabo cálculos simples y encontrar el valor de Mr (H 2 O) – peso molecular relativo de agua. Por Tabla Periódica se define que la masa de oxígeno – 16, el hidrógeno – 1. Draw sencilla cálculos: M r (H 2 O) = 1 + 2 • 16 = 18, donde M r – peso molecular, H 2 O – molécula de agua, H – hidrógeno elemento símbolo O – señal química de oxígeno.
masas de los isótopos
elementos de naturaleza química y la tecnología existen como varias especies de átomos – isótopos. Cada uno de ellos tiene un peso individual, su valor no puede ser un valor fraccionario. Sin embargo, el peso atómico del elemento químico a menudo es un número con múltiples signos después del punto. Cuando los cálculos tienen en cuenta la prevalencia de cada especie en la corteza terrestre. Por lo tanto, la masa de los átomos en la tabla periódica no son necesariamente números enteros. Usando estos valores para los cálculos, se obtiene la masa de las moléculas, que tampoco son números enteros. En algunos casos, puede ser un valor de redondeo.
El peso molecular de la estructura no molecular de la materia
La mayoría de los compuestos inorgánicos no son la estructura molecular. Metales están compuestos de átomos, iones y electrones libres, sales de – de cationes y aniones. Para las sustancias estructuras de peso no moleculares también contadas moléculas condicionales de fórmula bruta, lo que refleja la estructura más simple. Nos encontramos con el Sr. valor para la estructura de las sustancias iónicas – sal cuya fórmula NaCl. M r = 23 + 35,5 = 55,5. Para algunos tipos de cálculos requeridos masa molecular de mezcla aire – gas. Teniendo en cuenta el porcentaje de las diferentes sustancias en la atmósfera, la molecular masa del aire es 29.
El tamaño y la masa de las moléculas
micrografías electrónicas de moléculas grandes pueden considerar los átomos individuales, pero son tan pequeños que un microscopio ordinario no puede ser visto. tamaño de partícula lineal de cualquier sustancia como el peso, – una característica constante. El diámetro de la molécula depende de los radios de sus átomos constituyentes, su atracción mutua. Los tamaños de partícula varían con el número de protones y niveles de energía. átomo de hidrógeno – el más pequeño en tamaño, su radio es sólo el 0,5 • 10 -8 átomo cm de uranio es tres veces más átomos de hidrógeno .. Estos "gigantes" del microcosmos – las moléculas de las sustancias orgánicas. Por lo tanto, uno de la dimensión lineal de la partícula de proteína es de 44 • 10 -8 cm.
Para resumir: la masa de las moléculas – es la suma de las masas de los átomos dentro de ellos. El valor absoluto en kilogramos se puede obtener multiplicando el peso molecular que se encuentra en la Tabla Periódica, la cantidad 1,66 • 10 -27 kg.
Las moléculas son insignificantes en comparación con los macro-cuerpos. Por ejemplo, en el tamaño de la molécula de agua H 2 O da la manzana como muchas veces, cuántas veces esta fruta es más pequeña que nuestro planeta.



















