Los ensayos cualitativos en fenol. Preparación de fenoles: Reacción
ácido carbólico – uno de los Fenol nombres, lo que indica su comportamiento especial en procesos químicos. Este material es más fácil que el benceno entra en reacción de sustitución nucleófila. Las propiedades inherentes de un compuesto se explican movilidad átomo de hidrógeno ácido en el grupo hidroxilo unido al anillo. El estudio de la estructura molecular y la respuesta de alta calidad para permitir que el compuesto de fenol incluyen compuestos aromáticos – derivados del benceno.
Fenol (hidroxibenceno)
En 1834, un químico alemán Runge asigna ácido carbólico del alquitrán de hulla, pero fue incapaz de descifrar su composición. Más tarde, otros investigadores han propuesto una fórmula, y llevado a una nueva conexión con el alcohol aromático. El representante más simple de este grupo – fenol (hidroxibenceno). En su forma pura, esta sustancia es un cristal transparente que tiene un olor característico. color de aire fenol puede cambiar para ser de color rosa o rojo. Para el alcohol típico pobre solubilidad aromático de agua fría y buena – en disolventes orgánicos. El fenol se funde a una temperatura de 43 ° C. Es un compuesto tóxico, contacto con la piel provoca graves quemaduras. El resto aromático es un radical de fenilo (C6H5-). Directamente con uno de los átomos de carbono de oxígeno está unido con un grupo hidroxilo (-OH). La presencia de cada una de las partículas de muestra de reacción cualitativa apropiado fenol. La fórmula muestra el contenido total de átomos de los elementos químicos en la molécula – C6H6O. Estructura reflejan fórmula estructural, incluyendo ciclo y grupo funcional Kekulé – hidroxilo. Representación visual de la molécula, un alcohol aromático dar modelo sharosterzhnevye.
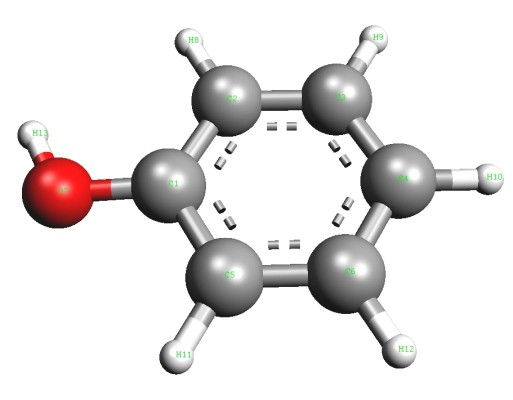
Características de la estructura molecular
Interferencia del anillo de benceno y el grupo OH define reacción química de fenol con metales, halógenos, otras sustancias. Después de haber unido al anillo aromático del átomo de oxígeno conduce a una redistribución de la densidad de electrones en la molécula. Comunicación O-H es más polar, lo que resulta en aumento de la movilidad del hidrógeno en el grupo hidroxilo. El protón puede ser sustituido por átomos de metal, lo que indica que la acidez del fenol. A su vez, el grupo OH aumenta las propiedades de reactivos del anillo de benceno. La deslocalización de los electrones aumenta, y la capacidad de sustitución electrofílica en el núcleo. Esto aumenta la movilidad de los átomos de hidrógeno unidos al carbono en la posición para y orto (2, 4, 6). Este efecto es debido a la presencia de la densidad de electrones de donantes – grupo hidroxilo. Debido a su influencia fenol activo que el benceno se comporta en reacciones con determinadas sustancias y nuevos sustituyentes orientados en las orto- y para-posiciones.
Las propiedades ácidas
El grupo hidroxilo del átomo de oxígeno alcohol aromático adquiere una carga positiva, lo que debilita su comunicación con hidrógeno. liberación de protones se facilita, por lo fenol se comporta como un ácido débil, pero más fuerte que alcoholes. reacción cualitativa a fenol incluyen la prueba de prueba de fuego en presencia de protones cambia de color de azul a rosa. La presencia de átomos de halógeno o grupos nitro asociado con el anillo de benceno lleva a un aumento en la actividad de hidrógeno. El efecto se observa en las moléculas nitro fenol. Bajar sustituyentes acidez tales como un grupo amino, y alquilo (CH3-, C2H5-, etc.). Los compuestos que reúne a un anillo de benceno, un grupo hidroxilo y un radical metilo, se refiere cresol. Sus propiedades son más débiles que el ácido carbólico.
reacción de fenol con sodio y alcalino
 Del mismo modo los ácidos fenol se hace reaccionar con metales. Por ejemplo, reacciona con el sodio: 2C6H5-OH + 2Na = 2C6H5-ONa + H2 ↑. Formado fenóxido de sodio, y el hidrógeno gaseoso se libera. El fenol se hace reaccionar con bases solubles. Se produce reacción de neutralización para formar una sal y agua: C6H5-OH + NaOH = C6H5 ONa + H2O. La capacidad de dar de hidrógeno en el grupo hidroxilo en el fenol es menor que la mayoría de los ácidos inorgánicos y carboxílicos. Se desplaza a partir de sales disueltas en el agua incluso dióxido de carbono (ácido carbónico). Ecuación de reacción: C6H5-ONa + CO2 + H2O = C6H5-OH + NaHCO3.
Del mismo modo los ácidos fenol se hace reaccionar con metales. Por ejemplo, reacciona con el sodio: 2C6H5-OH + 2Na = 2C6H5-ONa + H2 ↑. Formado fenóxido de sodio, y el hidrógeno gaseoso se libera. El fenol se hace reaccionar con bases solubles. Se produce reacción de neutralización para formar una sal y agua: C6H5-OH + NaOH = C6H5 ONa + H2O. La capacidad de dar de hidrógeno en el grupo hidroxilo en el fenol es menor que la mayoría de los ácidos inorgánicos y carboxílicos. Se desplaza a partir de sales disueltas en el agua incluso dióxido de carbono (ácido carbónico). Ecuación de reacción: C6H5-ONa + CO2 + H2O = C6H5-OH + NaHCO3.
Las reacciones del anillo de benceno
propiedades aromáticas son debido a electrones deslocalización en el núcleo de benceno. Hidrógeno del anillo está sustituido por átomos de halógeno, nitro. Un proceso similar en molécula de fenol es más fácil que la de benceno. Un ejemplo – la bromación. El benceno halógeno opera en presencia de un catalizador, bromobenceno obtenido. El fenol se hace reaccionar con agua de bromo en condiciones normales. La interacción de un precipitado blanco de 2,4,6-tribromofenol, cuya apariencia de distinguir la sustancia de ensayo similar a ella a partir de compuestos aromáticos. La bromación – reacción cualitativa para el fenol. Ecuación: C6H5-OH + 3Br2 = C6H2Br3 + HBr. El segundo producto de reacción – bromuro de hidrógeno. Cuando se hace reaccionar fenol con diluida de ácido nítrico obtenido derivado de nitro. El producto de reacción con un ácido nítrico concentrado – 2,4,6-trinitrofenol o ácido pícrico tiene un gran significado práctico.
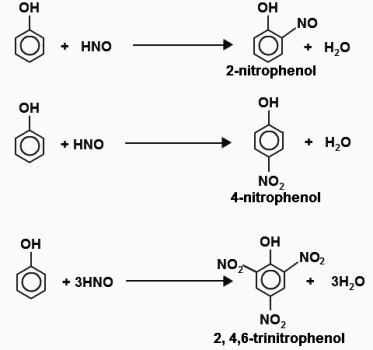
Los ensayos cualitativos en fenol. lista
En la interacción de sustancias obtenida ciertos alimentos que le permiten establecer la composición cualitativa de los materiales de partida. Una serie de reacción de color indica la presencia de partículas, los grupos funcionales que son útiles para el análisis químico. reacción cualitativa para probar la existencia de fenol por molécula de la sustancia el anillo y grupos OH aromáticos:
- La solución de fenol azul de tornasol papel rojo.
- fenoles de reacción de color también se realiza en un medio básico débil con sales de diazonio. Un amarillo o naranja colorantes azoicos.
- Se hace reaccionar con bromo precipitado marrón agua parece tribromofenol blanco.
- En la reacción con solución de cloruro férrico fenóxido obtenido férrico – sustancia azul, violeta o coloración verde.

conseguir fenoles
El fenol de producción en la industria se encuentra en dos o tres etapas. En la primera etapa del propileno y benceno en presencia de cloruro de aluminio producido de cumeno (isopropilbenceno nombre común). La ecuación de la reacción de la reacción de Friedel-Crafts: C6H5-OH + C3H6 = C9H12 (cumeno). El benceno y el propileno en una relación de 3: 1 se hace pasar sobre un catalizador ácido. Cada vez más, en lugar de la tradicional catalizador – cloruro de aluminio – ecológicamente zeolitas puras. En la etapa final de la oxidación se lleva a cabo con oxígeno en presencia de ácido sulfúrico: C6H5-C3H7 + O2 = C6H5-OH + C3H6O. Los fenoles se pueden derivar de la destilación de carbón, son intermedios en la producción de otras sustancias orgánicas.
El uso de fenoles
alcoholes aromáticos se utilizan ampliamente en la industria de plásticos, colorantes, pesticidas, y otras sustancias. la producción de ácido carbólico del benceno es el primer paso en la creación de un número de polímeros, incluyendo policarbonatos. El fenol se hace reaccionar con formaldehído, se obtienen resinas de fenol-formaldehído.

El ciclohexanol es la materia prima para la producción de poliamidas. Los fenoles se usan como antisépticos y desinfectantes en desodorantes, lociones. Se utiliza para obtener fenacetina, ácido salicílico y otros fármacos. Los fenoles se utilizan en la producción de resinas que se utilizan en los productos eléctricos (interruptores, enchufes). También se utilizan en la preparación de colorantes azoicos, tales como fenilamina (anilina). El ácido pícrico, que es los derivados nitrados de fenol utilizados para la tinción de tejidos, fabricación de explosivos.














